Tema 1 - Medida de los analitos por fotometría y espectrofotometría
- Espectro electromagnético: distribución energética del conjunto de la radiación electromagnética.
- Interacción de la energía radiante con la materia
La energía radiante (radiación electromagnética) puede manifestarse como movimiento ondulatorio (radiación electromagnética) o como si estuviese integrada por un flujo de partículas discretas o paquetes ondulatorios energéticos denominados “fotones”, es decir presentando propiedades electromagnéticas y energéticas. Ambos modelos son complementarios.
2.1. Parámetros ondulatorios:
- Amplitud(A): longitud del vector eléctrico máximo en la onda.
- Longitud de onda (λ): distancia entre dos puntos que se encuentran en el mismo punto de vibración.
- Período (T): tiempo en segundos (s) que tarda una partícula en realizar una vibración completa.
- Frecuencia (v): número de oscilaciones completas que una partícula realiza en una unidad de tiempo, generalmente un segundo.
- Comportamiento de la materia ante la radiación electromagnética
La materia está constituida por átomos, iones o moléculas.
En los átomos los electrones se disponen en orbitales más o menos alejados del núcleo adoptando una configuración característica.
En las moléculas los enlaces covalentes entre átomos se forman porque los electrones que los constituyen se localizan alrededor de los dos centros atómicos, de tal manera que se minimizan las fuerzas de repulsión. Las zonas interatómicas, ocupadas por electrones enlazantes, se conocen como orbitales moleculares y se pueden considerar como la superposición de orbitales atómicos.
Cuando se incide sobre la materia con una energía radiante, tienen lugar determinadas transiciones electrónicas desde unos orbitales a otros. Estas transiciones electrónicas determinan cambios en el estado energético de átomos o moléculas, cambios que son característicos de cada especie atómica o molécula, por ello cada átomo o molécula absorbe una energía radiante de características definidas.
En base a este comportamiento, se aplican las técnicas analíticas espectroscópicas para identificar y/o cuantificar en muestras biológicas los parámetros indicadores de estados fisiológicos o patológicos
3.1. Absorción atómica: en los átomos, los electrones ocupan alrededor del núcleo determinados niveles energéticos que definen orbitales característicos para cada tipo de átomo. En estas condiciones, un átomo, se encuentra en su “estado fundamental” o de menor energía, su configuración electrónica es estable y tiende a mantenerla o a recuperarla si ésta ha sido alterada, por incidir sobre ella radiación
3.2. Absorción molecular: los espectros de absorción de las moléculas poliatómicas son más complejos que los espectros atómicos al presentar un mayor número de transiciones entre sus numerosos estados, esto supone una gran cantidad de líneas espectrales, tantas que se superponen entre ellas dando lugar a los espectros de bandas que abarcan un intervalo considerable de longitudes de onda.
3.3. Emisión: proceso que se produce cuando la materia se relaja y cede su exceso de energía en forma de fotones.
- Ley de Lambert-Beer
Ley que indica la relación directamente proporcional que existe entre la absorbancia de una muestra y su concentración, al ser constantes los valores del trayecto óptico, la longitud de onda de la radiación incidente, la absortividad (cantidad de luz absorbida por una solución.
La relación directamente proporcional entre la absorción de la radiación por parte del analito y su concentración en la muestra no es lineal en cualquier situación. Existen una serie de condiciones limitantes o desviaciones de esta ley que dependen de determinadas características del analito o que tienen un origen instrumental o químico, en las que la relación no presenta linealidad. Estas desviaciones son:
- Dependientes de las características del analito
- Limitaciones químicas
- Limitaciones instrumentales
La Ley de Lambert-Beer se cumple para un trayecto óptico de 1 cm (cubeta estandarizada).
4.1. Curva de calibración: representación gráfica en un eje de coordenadas de absorbancia (ordenadas) frente a concentración (abscisas). Para construir la curva de calibración (que debe ser una recta) se ensayan varias soluciones de concentraciones conocidas y se determinan sus absorbancias, luego se representan gráficamente sus concentraciones frente a sus absorbancias.
La concentración de la muestra a analizar se obtiene por interpolación de su absorbancia en la curva de calibración.
4.2. Linealidad: en las determinaciones fotométricas se debe conocer la linealidad, que es el intervalo de concentraciones del cromógeno entre las cuales existe una relación lineal entre concentración y absorbancia.
- Conceptos
Fotometría: medida de las magnitudes relativas a las radiaciones, evaluadas según la impresión visual producida por éstas y basándose en ciertas convenciones.
Fotómetro: instrumento que sirve para medir la intensidad de una fuente luminosa.
Espectrómetro: aparato utilizado para medir la distribución de una radiación compleja en función de la longitud de onda o de la frecuencia si se trata de ondas y de la masa o de la energía de las partículas individuales si se trata de partículas.
Espectrofotometría: en química analítica es una técnica de medición que asocia el análisis espectral de la espectroscopia a la medición de magnitudes fotométricas relativas, en la mayoría de los casos relacionados con las propiedades de la materia.
Permite aislar, en la radiación compleja emitida por una fuente, una radiación casi monocromática que caracteriza cualitativa y cuantitativamente la materia que ha atravesado.
En el rango de concentraciones adecuado las leyes de absorción de Lambert-Beer permiten un análisis cuantitativo.
- Técnicas espectroscópicas analíticas
Cada tipo de radicación afecta a un nivel diferente de la estructura atómica y molecular, esto nos permite clasificar diferentes tipos de técnicas espectroscópicas.
- Sistemas ópticos espectroscópicos
Espectrofotómetro: instrumento que combina las propiedades del espectrómetro y del fotómetro y permite la determinación de intensidades relativas de radiaciones simples, elegidas a voluntad entre las muestras dadas.
Un espectrofotómetro consta de:
- Fuente de radiación: es el origen de la emisión energética en forma de radiación electromagnética lo suficientemente potente y estable para que sea posible su detección y su medida una vez que ha atravesado la muestra.
- Sistema de depósito de la muestra biológica
- Selector de longitud de onda: tiene la función de seleccionar o discriminar una banda estrecha de longitud de onda de las procedentes de la fuente de radiación con la finalidad de aumentar la sensibilidad de la medida de absorbancia.
- Detectores: sistemas que amplifican y transforman la energía radiante no absorbida por la muestra en energía eléctrica y la convierten en una señal eléctrica y cuantificable.
- Sistemas de registro y presentación de datos.
Los sistemas ópticos utilizados en espectrofotometría tienen su base en éstos cuatro fenómenos:
- Absorción
- Emisión
- Dispersión
- Luminiscencia-fluorescencia, fosforescencia y quimioluminiscencia.
Muchos de los métodos analíticos espectrofotométricos resultan de la aplicación de la ley de Lambert-Beer. La selectividad en la absorción o emisión de energía por parte de la materia, ha hecho posible el desarrollo de métodos analíticos cuya finalidad es la detección en fluidos y tejidos biológicos de:
- Ausencia o presencia de parámetros analíticos.
- Cuantificación de la concentración de estos parámetros.
- La actividad de numerosas enzimas.
Estos parámetros son indicadores de determinados estados tanto fisiológicos como patológicos y, junto a otras pruebas, permiten la prevención, el diagnóstico, el tratamiento o la evaluación del seguimiento del tratamiento de estos estados de salud.
TEMA 2 - ESPECTROFOTOMETRÍA UV-VISIBLE
1) Definición y fundamentos:
La espectroscopia ultravioleta-visible o espectrofotometría ultravioleta-visible (UV/VIS) es una espectroscopia (estudio de la interacción entre la radiación electromagnética y la materia) de fotones y una espectrofotometría. Utiliza radiación electromagnética (luz) de las regiones visible, ultravioleta cercana (UV) e infrarroja cercana (NIR) del espectro electromagnético. La radiación absorbida por las moléculas desde esta región del espectro provoca transiciones electrónicas que pueden ser cuantificadas.
Todas las sustancias pueden absorber energía radiante. La absorción de las radiaciones UV, visibles e IR depende de la estructura de las moléculas, y es característica para cada sustancia química. El color de las sustancias se debe a que absorben ciertas longitudes de onda de la luz blanca que incide sobre ellas y sólo dejan pasar a nuestros ojos aquellas longitudes de onda no absorbida.
Esta espectrofotometría utiliza radiaciones del campo UV de 80 a 400 nm, principalmente de 200 a 400 nm (UV cercano) y de luz visible de 400 a 800 nm, por lo que es de gran utilidad para caracterizar las soluciones en la región ultravioleta-visible del espectro. Se rige por una ley muy importante: la ecuación de Beer-Lambert.1.1. Fuentes de radiación:
· Lámparas descarga de Deuterio e Hidrógeno. La excitación eléctrica a presión reducida de estos elementos genera una radiación continua en la banda espectral correspondiente al UV
· Lámparas de filamentos de Tungsteno. Origina radiación de la región visible e infrarrojo cercano del espectro entre 350-2.500nm
· Lámparas de arco de Xenón. La excitación eléctrica de una atmósfera de Xenón genera una radiación continua en la banda espectral de 250 a 600 nm
2) Finalidad diagnóstica:
La espectrometría UV/Visible se utiliza habitualmente en la determinación cuantitativa de soluciones de iones metálicos de transición y compuestos orgánicos muy conjugados.
Soluciones de iones metálicos de transición
Compuestos orgánicos
El espectrofotómetro UV/Vis puede utilizarse como detector para la Cromatografía Líquida de Alta Resolución HPLC. La presencia de un analito da una respuesta que puede ser proporcional a la concentración. Para resultados precisos, la respuesta del instrumento al analito debe compararse con la respuesta a un estándar, lo que es muy similar al uso de curvas de calibración. La respuesta para una concentración particular se conoce como factor de respuesta.
Las soluciones de iones metálicos de transición pueden ser coloreadas (es decir, absorben la luz visible) debido a que los electrones en los átomos de metal se pueden excitar desde un estado electrónico a otro. El color de las soluciones de iones metálicos se ve muy afectado por la presencia de otras especies, como algunos aniones o ligandos.
Los compuestos orgánicos, especialmente aquellos con un alto grado de también absorben luz en las regiones del espectro electromagnético visible o ultravioleta. Los disolventes para estas determinaciones son a menudo el agua para los compuestos solubles en agua, o el etanol para compuestos orgánicos solubles. Los disolventes orgánicos pueden tener una significativa absorción de UV, por lo que no todos los disolventes son adecuados para su uso en espectrometría UV. El etanol absorbe muy débilmente en la mayoría de longitudes de onda. La polaridad y el pH del disolvente pueden afectar la absorción del espectro de un compuesto orgánico.
Aunque los complejos de transferencia de carga también dan lugar a colores, éstos son a menudo demasiado intensos para ser usados en mediciones cuantitativas.
3) Ventajas e inconvenientes:
- Ventajas:
1) Rapidez
2) Uso fácil
3) Precisión extrema
4) Versatilidad
5) Eficiencia en el costo
6) Sensibilidad
7) Análisis de superficies irregulares y materiales duros
8) Preparación mínima de la muestra
- Inconvenientes:1) En aquellas muestras que requieren disolución es necesario que esta se lleve a
cabo en el disolvente adecuado; y si estamos utilizando una celda de paso fijo
es necesario asegurarse que la distancia no varíe para análisis cuantitativo.
2) Los problemas asociados con dichas celdas incluyen la aparición de burbujas
que dan lugar a bandas erróneas.
3) Suele aparecer la banda del disolvente, pudiendo llegar a interferir.
4) Las ventanas de las células no estén completamente paralelas.
5) En sólidos, hay problemas a la hora de tomar la misma cantidad de muestra.
Tema 3. Nefelometría y turbidimetría
DEFINICIÓN: ¿QUÉ ES?
Nefelometría y / o Turbidimetría son métodos analíticos basados en la dispersión de partículas suspendidas en líquidos.
-Nefelometría: mide la luz dispersada en dirección distinta a la luz emitida (generalmente con ángulos que oscilan entre 15 y 90º). Utiliza como instrumento el nefelómetro (en el que el detector se ubica con un ángulo que oscila entre 15 y 90º ej. a 90º). Se suele utilizar para concentraciones más diluidas. Permite mayor sensibilidad con concentraciones menores de partículas suspendidas. Constituye un método más exacto para la medida de la opacidad.
FUNDAMENTO: ¿EN QUÉ SE BASA?
Cuando la luz atraviesa un medio transparente en el que existe una suspensión de partículas sólidas, se dispersa en todas direcciones y como consecuencia se observa turbia.
La turbidez es la propiedad óptica de una muestra que hace que la radiación sea dispersada y absorbida más que transmitida en línea recta a través de la muestra. Es ocasionada por la presencia de materia suspendida en un líquido. Y para medirla utilizamos ambos métodos. La dispersión no supone la pérdida neta de potencia radiante, sólo es afectada la dirección de la propagación, la intensidad de la radiación es la misma en cualquier ángulo.
En la turbidimetría se compara la intensidad del rayo de luz que emerge con la del que llega a la disolución. En cambio, en la nefelometría la medida de la intensidad de luz se hace con un ángulo de 90º con respecto a la radiación incidente.
El instrumento usado en la nefelometría, el nefelómetro en cambio en turbidimetría se utiliza el turbidímetro que es un fotómetro de filtro.
El procedimiento de la nefelometría generalmente es empírico y sólo se consideran 3 factores:
1. La concentración: Mayor sea el número de partículas, mayor es la dispersión.
2. Tamaño de la partícula: Factores como el pH, la velocidad y orden de la mezcla, concentración de los reactivos y la fuerza iónica.
3. Longitud de onda: Generalmente las muestras se iluminan con luz blanca, pero si están coloreadas, se debe escoger una porción del espectro electromagnético en la que la absorción del medio se reduzca al mínimo
Diferencias turbidimetria y nefelometría
La nefelometría se basa en la medición de radiación dispersa, en cambio la turbidimetría en la medición de la intensidad de un haz disminuido.
Factores para la elección entre turbidimetría y nefelometría:
- Intensidad de la radiación transmitida o dispersada con la intensidad de la radiación procedente de la fuente.
La mejor elección cuando la muestra contiene pocas partículas dispersantes es la nefelometría. La turbidimetría es buena cuando las muestras contienen grandes concentraciones de partículas dispersantes.
- Tamaño de las partículas dispersantes. En la nefelometría la intensidad de la radiación dispersada a 90º es mayor si las partículas son bastante pequeñas para que se produzca una dispersión Rayleigh. Si las partículas son mayores la intensidad de la dispersión disminuirá.
En turbidimetría la señal consiste en la disminución relativa de la radiación transmitida, por lo que el tamaño de las partículas dispersantes es menos importante.
Se utilizan normalmente en el análisis de la calidad química del agua, para determinar la claridad y para el control de los procesos de tratamiento. También para la determinación de iones sulfato.
Turbidimetría:
-Se utiliza para el análisis de fibrinógeno, triglicéridos, complejos Ag-Ac y otras sustancias.
- Aplicable cuando la dispersión es suficientemente grande (concentración alta de partículas).
Nefelometría:
- Preferible para concentraciones bajas de partículas, ya que la dispersión es menor y la disminución de intensidad del haz incidente es pequeña.
- Se suele utilizar para medir concentraciones específicas de colonias de bacterias en algún medio de cultivo, o de muchas proteínas utilizando el principio de dispersión luminosa molecular.
TEMA 4 - FLUORIMETRÍA Y QUIMIOLUMINISCENCIA
FLUORESCENCIA, FOSFORESCENCIA Y QUIMIOLUMINISCENCIA
Dentro de los fenómeno llamado luminiscencia se encuentran el de fluorescencia, fosforescencia y quimioluminiscencia.
FLUORESCENCIA
Definición y fundamento
Es la luminiscencia causada única y exclusivamente por rayos ultravioleta. El término fluorescencia proviene del mineral que presenta este fenómeno por naturaleza, la fluorita.
La fluorescencia se produce cuando una molécula absorbe luz de una determinada longitud de onda(energía), y emite luz de una longitud de onda superior (menor energía).
Cuando una molécula es excitada por un haz de luz de una intensidad y energía determinadas, absorbe energía y se produce el paso de sus electrones de un estado basal a un estado excitado, liberando esta energía en forma de luz, resultando en una emisión fluorescente o fluorescencia.
Fluorimetría
La fluorimetría combina la fotometría con la alta sensibilidad y especificidad del fenómeno fluorescente. Para la medida de la fluorescencia se usan:
- Fluorímetros que usan filtros interferenciales o filtros de vidrio.
- Espectrofluorímetros que usan prismas o redes de difracción.
Los componentes básicos de estos aparatos son:
1. Fuente de luz de excitación (energía radiante): Se pueden emplear lámparas de arco de xenón o lámparas de mercurio
2. Rendijas de excitación y emisión: Son iguales a las del espectrofotómetro(orientan el haz de luz).
3. Monocromadores (de excitación y de emisión):
- Monocromadores de excitación: para seleccionar la longitud de onda de excitación deseada.
- Monocromadores de emisión: para eliminar las longitudes de onda emitidas no deseadas
4. Cubetas: De sílice o cuarzo. Las de plástico pueden causar fluorescencia adicional con pérdida de sensibilidad.
5. Detector: Fototubos multiplicadores capaces de cuantificar la pequeña señal fluorescente.
Los fluorímetros están diseñados en ángulo recto para que la luz procedente de la lámpara (de excitación) no llegue al monocromador de emisión y al detector.
La mayor ventaja de la fluorimetría => su enorme sensibilidad (respecto a las técnicas colorimétricas) por el aumento de la intensidad de la radiación de excitación y la sensibilidad del dispositivo de detección.
La señal fluorescente dependerá => del solvente, pH, temperatura, de la absorbancia de luz por la solución, de interferentes que aporten fluorescencia no deseada, de compuestos que atrapan luz (atenúan la fluorescencia que se pierde en forma de calor).
Aplicaciones
En bioquímica:
- análisis de alimentos y fármacos.
En bioquímica clínica:
- muestras biológicas de iones, enzimas, coenzimas, vitaminas, algunos medicamentos, etc.
Su gran aplicación es el fluoroinmunoanálisis que utiliza Ac marcados con una sustancia fluorescente, específicos de la sustancia a estudiar.
FOSFORESCENCIA
Definición
La fosforescencia es un fenómeno en el cual ciertas sustancias tienen la propiedad de absorber energía y almacenarla, para después emitirla gradualmente en forma de luz .
El principio físico en el que se basa la fosforescencia es el mismo que el de la fluorescencia, la principal diferencia radica en la forma de emitir la luz absorbida. En la fluorescencia es casi simultánea, y en la fosforescencia es retardada.
En la fosforescencia, los átomos poseen estados metastables donde se pueden almacenar energía durante un tiempo relativamente largo. Y, emiten esta energía absorbida (con longitud de onda bastante mas larga que la de absorción) de forma gradual, durante minutos, horas e incluso días.
Fosforimetría
Técnica espectroscópica luminiscente basada en la detección y análisis de la emisión de radiaciones electromagnéticas de una especie excitada por absorción de fotones.
Los métodos fosforescentes y fluorescentes se complementan, ya que los compuestos fuertemente fluorescentes presentan una débil fosforescencia y viceversa
Ventajas (con respecto a la fluorescencia)
- Más tiempo de vida
- Más sensibilidad
- Más selectividad
- Más linealidad de la respuesta
- Posibilidad de utilizar concentraciones de < ng/ml
Inconvenientes
- Necesidad de utilizar bajas temperaturas (nitrógeno líquido).
- Imprecisión en las medidas.
- Cierta dificultar experimental.
Tipo de luz utilizada:
- Ultravioleta
- Visible
- Infrarrojo próximo
Aplicaciones
- Presencia de fármacos en sangre
- Presencia de fármacos en orina (útil para control de dopaje)
- Presencia de Uranio en orina, suelo, agua, vegetales, filtros,...
- Determinación de ácidos nucleicos, aminoácidos, pirina, pirimidina, enzimas, hidrocarburos del petróleo, vitaminas, pesticidas,...
Aparatos utilizados en fosforimetría
Se utiliza el fosforímetro o espectrofosforímetro, este aparato presenta dos componentes adicionales al fluorímetro:
Ø Fosforoscopio, u obturados rotatorio. Éste alterna la irradiación de la muestra y la medición de la intensidad de fosforescencia, después de un tiempo determinado.
Ø Un compartimento específico, para la muestra, que permita mantener la muestra a la temperatura adecuada (Nitrógeno líquido). Suele ser con ventanas de cuarzo.
QUIMIOLUMINISCENCIA
Definición
Fenómeno que en algunas reacciones químicas, la energía liberada no sólo se emite en forma de calor o de energía química sino en forma de luz.
Fundamento
Normalmente, en estas reacciones de quimioluminiscencia se liberan moléculas con estado excitado que al bajar a su estado emiten la diferencia de energía en forma de luz.
A medida que progresa la reacción, los cambios de la composición química y la luz, disminuyen hasta desvanecerse por completo como resultado de la conversión. Generalmente la quimioluminiscencia es muy breve.
Relacionado con la quimioluminiscencia:
- Bioluminiscencia: fenómeno producido por reacciones químicas de origen biológico, uno de los casos más conocidos es la luz emitida por las luciérnagas, también algunas bacterias, hongos, insectos...
Tipos de quimioluminiscencia:
- Quimioluminiscencia directa: marcaje de sustancias sólidas con éster de acridina (quimioluminiscente) recubiertas por Acs específicos contra la sustancia a analizar. Cuando se oxida la sustancia empleada para el marcaje se emite luz.
- Quimioluminiscencia indirecta: emplea como marcaje una enzima y produce una fuerte emisión de luz.
Permite hacer numerosas lecturas y aumentar la precisión.
Ventajas
- Alta sensibilidad y especificidad.
- Alta precisión.
- No emplea radioactividad.
- No genera riesgo contaminante ni ruido de fondo.
- Equipo automatizado y fácil manejo.
- Los resultados obtenidos son equiparables con Radioinmunoanálisis.
Aplicaciones
- No es muy usada en la clínica.
- Análisis medioambientales (restos de impurezas en el aire, contaminantes atmosféricos...)
- Clínica forense (para la determinación de rastros de sangre)
Diferencia entre fosforescencia, fluorescencia y quimioluminiscencia:
el el fenómeno fosforescencia es el mismo que el de la fluorescencia, la principal diferencia radica en la forma de emitir la luz absorbida. En la fluorescencia es casi simultánea, y en la fosforescencia es retardada, y en la quimioluminiscencia se basa a partir de reacciones químicas liberando energía en forma de luz que se va apagando a medida que cesa la reacción.
Tema 5
Espectrofotometría de absorción atómica y fotometría de llama
Espectrofotometría de absorción atómica y fotometría de llama
ESPECTROFOTOMETRÍA DE ABSORCIÓN ATÓMICA
Es una técnica para determinar la concentración de un elemento metálico determinado en una muestra. Puede utilizarse para analizar la concentración de más de 62 metales diferentes en una solución. Los elementos a analizar se encuentran en forma de vapor de átomos. Ahora bien, en absorción atómica existe una fuente independiente de luz monocromática, específica para cada elemento a analizar y que se hace pasar a través del vapor de átomos, midiéndose posteriormente la radiación absorbida.
Para poder analizar la muestra es imprescindible tenerla atomizada utilizando un flujo de gas oxidante mezclado con gas combustible, es decir, que mediante un flujo la muestra líquida o en disolución va a ser aspirada por un capilar; Cuando la solución sale del capilar el gas la dispersa en forma de fina niebla. Para que la precisión de los análisis sea buena hay que poder reproducirlas en todas las medidas: el flujo de los gases y el tamaño de gota.
En esta atomización se dan 3 fases:
· DESOLVATADA
El liquido disolventes evapora y la muestra permanece seca.
· VAPORIZACIÓN
La muestra sólida se evapora a gas.
· ATOMIZACIÓN
Los compuestos de la muestra se dividen en átomos libres.
En un espectrofotómetro de AA es necesario utilizar una llama aunque esta también la podemos sustituir por un horno de grafito. Las llamas utilizadas en la AA son similares a la técnica de emisión de llama
· Llama de aire-hidrocarburos
· Llama de aire –acetileno
· Llama de oxido nitroso-acetileno
La temperatura de la llama es lo suficientemente baja como para no excitar los átomos de la muestra de su estado basal. Según la temperatura encontramos tres tipos de llamas:
- llamas frías.
- llamas calientes.
- llamas mas calientes.
La más utilizada en analítica clínica es la Llama caliente ya que puede atomizar hasta 30 elementos.
COMPONENTES:
Fuente de luz: lámpara de cátodo hueco que consiste en un ánodo de wolframio y un cátodo cilíndrico cerrados herméticamente en un tubo de vidrio lleno de neón/argón, y el cátodo está constituido con el metal cuyo espectro se desea obtenerMonocromador: son prismas o redes de difracción que sirven para hacer pasar la luz atreves del sistema óptico.
Detector: el sistema de detección puede estar formado por foto celdas, fotomultiplicador, etc. Que reciben la energía lumínica proveniente de la muestra y la convierte en una señal eléctrica proporcional a la energía recibida.
NOTA: Las cubetas a utilizar pueden ser de cristal o de plástico, macrocubetas o microcubetas.
APLICACIONES
En química analítica se emplea para medir las concentraciones de elementos metálicos en los líquidos biológicos, los principales metales que se miden son:
Aluminio- arsénico-bario –cadmio- calcio- cobre- cromo- hierro-litio-magnesio-manganeso-mercurio-níquel –plata-platino- plomo -selenio y zinc.
FOTOMETRIA DE LLAMA
Es una técnica de emisión que utiliza una llama como fuente de excitación y un fotodetector electrónico como dispositivo de medida. Se pueden realizar análisis monoelementales o multielementales, en este segundo caso se emplean sistemas selectores entre la muestra y el detector que son capaces de discriminar en un periodo de tiempo corto varias longitudes de onda de emisión de los diferentes elementos que se pretenden analizar en la muestra.
En la fotometría de llama se pueden realizar 2 tipos de análisis:
ANALISIS CUALITATIVO
Identifica los componentes de una muestra y examina las longitudes de onda del espectro de emisión (la muestra debe estar disuelta)
ANALISIS CUANTITATIVO
Es más sencillo y preciso, sirve para detectar metales alcalinos o alcalino térreos también determina la cantidad de sustancias en una muestra.
El equipo de llama se compone de:
· MONOCROMADOR: Prismas
· FOTODETECTOR: Dispositivo encargado de captar la señal óptica proveniente del monocromador y transformarlo en una señal electrónica capaz de ser convertida en un valor legible.
· MEDIDOR: Se encarga de tomar la D.O de la muestra.
· REGISTRADOR: convierte un resultado en valor numérico.
La llama en el espectrofotómetro durante el análisis requiere combustible y oxidante, típicamente en forma de iones.
Estos métodos a menudo son capaces de analizar elementos metálicos en ppm, billones e incluso hasta rangos más bajos de concentración. Se debe controlar las etapas necesarias de los átomos que constituyen una muestra hasta su estado fundamental, para ello; hay que sustituir la llama por una cámara de grafito y con esto aumenta también la sensibilidad.
Es esencial que la temperatura de la llama se mantenga constante, para lo cual se precisan reguladores.
ATOMIZADORES CON LLAMA
Su función es convertir los átomos combinados de la muestra en átomos en estado fundamental, para ello es necesario suministrar a las muestras una cantidad de energía suficiente para disociar las moléculas y romper sus enlaces.
FUNCIONES BASICAS DE LA LLAMA:
Ø Permite pasar la muestras a analizar de estado liquido a gaseoso.
Ø Descompone los compuestos moleculares en átomos individuales o moléculas sencillas.
Ø Excita estos átomos o moléculas.
Las condiciones que debe cumplir una llama deben de ser, que tenga la temperatura adecuada y que en ella se forme un ambiente gaseoso que permita las funciones mencionadas. Además el ruido de fondo de la llama no debe interferir en las observaciones.
APLICACIÓN:
Es una técnica aplicable para la cuantificación de diversos componentes como los elementos alcalinos o alcalinotérreos, aunque en realidad solo se miden concentraciones de sodio (Na) potasio (K) y litio (Li), pero suele utilizarse otras técnicas para esta medición ya que resulta más económicas; Las muestras habitualmente utilizadas son líquidos biológicos que deben de estar en solución acuosa con determinados diluyentes y estos suelen contener litio o cesio.
- Cono interno: hay una combustión parcial es decir sin equilibrio térmico en esta se forman productos de oxidación intermedios, se produce una gran emisión de luz (proviene del combustible, no de la muestra), es muy poco utilizada en el trabajo analítico
- Zona interconal: o llamada parte caliente de la llama y en ella tiene lugar una combustión completa. Es la más utilizada en análisis
- Cono externo: es la zona de combustión secundaria. Se enfría por el aire circundante y es una zona poco útil.
Tema 6 - Refractometría y Reflectancia
REFRACTOMETRIA
Es una técnica analítica que consiste en la medida del indice de refracción de un líquido con objeto de investigar su composición si se trata de una disolución o de su pureza si es un compuesto único. La medida continua en una columna cromatográfica puede indicar la composición o pureza del eluyente.
Principios básicos
La refractometría de la luz es un fenómeno de desvío que experimenta el haz incidente al atravesar una solución, ocasionado por la diferente naturaleza del aire y de la solución sobre la que incide. El ángulo de desvío se denomina ángulo de refracción.
Se conoce como índice de refracción (n) de una solución a la relación entre la velocidad de la luz en el aire y la velocidad de la luz a su paso por esta solución. Su valor es directamente proporcional a la cantidad de sustancias disueltas en la misma. Esta relación varía dependiendo de características como la concentración de sustancias disueltas, el tipo de disolvente, etc. Se puede calcular la concentración de solutos en una solución midiendo su índice de refracción.
En suero y plasma, el indice de refracción depende fundamentalmente de la proteína mayoritaria, la albúmina.
Refractómetro clínico
Son instrumentos basados en el fenómeno de la refracción de la luz para medir la concetración de sustancias disueltas en una solución acuosa. Las determinaciones se realizan gracias a la refracción entre el prisma, de índice de refracción elevado y la muestra.
En el caso de muestras de baja concentracción, la diferencia entre los índices de refracción de la muestra y el prisma es elevada y el ángulo de refracción es amplio. Cuando las muestras presentan una concentración de solutos elevada, la diferencia entre los índices es menor y, por lo tanto el ángulo de refracción es tambien menor.
En el laboratorio de análisis clínicos se emplea el refractómetro para la medición de la concentración de solutos tales como la albúmina en muestras séricas y/o plasmáticas , y la medida del peso específico en orina.
REFRACTÓMETRO
Medida
-Colocar sobre el prisma una (s) gota (s) de la solución a analizar y cerrar la placa.
-Dejar un tiempo para que la solución problema fluya sobre la superficie del prisma.
-Dirigir el refractómetro hacia la luz para obtener un buen contraste luz-sombra.
-Rotar el ocular hasta enfocar la escala.
-Mirar por el ocular leyendo directamente en la escala de concentración .
-Corregir la medida si la temperatura es diferente a la de calibración del refractómetro.
Utilización
Utilización
En la actualidad se emplea poco ya que sus medidas están incluidas en otros sistemas analíticos más sencillos, rápidos (como la tira reactiva) y automatizados (auto-analizadores que incluyen tanto el peso específico como la concentración de albúmina).
Donde se emplea
-en la industria vitivinícola: para determinar los azúcares totales de un mosto y a partir de alli poder hacer una estimacion del grado alcoholico
-en la industria alimenticia: en los laboratorios de bromatologia
-en veterinaria.
ESPECTROFOTOMETRIA DE REFLEXION
1. TIPOS DE REFLEXIÓN
Cuando un haz de luz incide sobre una superficie, la luz es reflejada por esta superficie, produciéndose a la vez dos tipos de reflexión:
--Una reflexión especular, en donde la luz es reflejada como lo haría en un espejo.
--Una reflexión difusa (reflectancia), que consiste en la reflexión producida al penetrar la luz en las capas internas de la superficie iluminada.
Dentro de la fase solida, la luz sufre una serie de fenómenos de absorción y dispersión.
Este tipo de reflexión es de interés para las mediciones que se realizan con las técnicas de química seca.
2. ESPECTROFOTÓMETRO DE REFLEXION
La fotometría de reflectancia implica la medida de la intensidad de la luz que es reflejada por una fase sólida, tras iluminar ésta con un haz de luz de una longitud de onda que es absorbida por los productos de interés.
Los espectrofotómetros de reflexión miden la reflectancia y la relacionan con la concentración del analito de interés.
Sus componentes son:
a. Fuente de luz: se emplean dos tipos de lámparas, que pueden ser de haluro de tungsteno o de xenón.
b. Sistemas ópticos: consisten en combinaciones de lentes, espejos y filtros.
c. Reactivos de fase sólida: aquí radica una de las diferencias fundamentales con la fotometría de absorción. La muestra se situa en los reactivos de fase solida (tiras reactivas, reactivos multicapa). Todos los componentes necesarios para que se produzca la reacción se encuentran impregnados en estas unidades, en las que tiene lugar la reacción y la lectura.
d. Detector y procesador de datos
e. Lectura: se puede hacer de dos formas
Lectura sobre la superficie
La muestra se aplica sobre la superficie del reactivo, difunde y se produce la reacción. El color resultante se determina midiendo la reflectancia sobre la superficie. Este método se emplea en los sistemas que utilizan tiras reactivas.
Lectura por el reverso de la superficie
La muestra se aplica sobre la superficie del reactivo, difunde y se produce la reacción. La lectura se hace por el reverso de la superficie de la muestra. Este método se emplea en los sistemas que utilizan reactivos multicapas o slides.
Los reactivos de química seca constituyen la manera de introducir la muestra en los fotómetros de reflexión. Son unidades de reacción con una sólida: poseen en forma deshidratada, todos los componentes que se necesitan para la identificación de un analito determinado.
Modo de empleo: la muestra que contiene el analito a determinar (suero, plasma, sangre total, orina) se aplica sobre la superficie del reactivo en fase sólida, y a partir de esta difunde a la matriz, disolviendo los componentes de reacción que contiene; cuando los reactivos se disuelven se produce la reacción, que se cuantificara por fotometría de reflectancia.
Todos los sistemas constan de tres partes:
Parte soporte
Está constituida por una lamina de plástico, sobre la cual se construye el reactivo de fase solida.
Parte reflectante
Su función es reflejar la luz; está hecha de materiales reflectantes como metales, o materiales fibrosos como el papel.
Parte reactiva
Contiene, en forma deshidratada todos los reactivos y sustancias auxiliares necesarias para que se produzca una reacción. Los reactivos son reconstituidos mediante rehidratación por el agua de la muestra
A veces se añaden otras capas con funciones complementarias como una capa difusora (con lo cual la muestra difunde rápidamente hacia los laterales y se distribuye uniformemente) o una capa separadora de plasma (la utilizan los sistemas preparados para trabajar con sangre total, su función es retener las células y permitir el paso del plasma hacia la matriz del reactivo).
La estructura de las capas depende del sistema reactivo de fase solida que se trate, variando de unos a Otros.
4. SISTEMAS REACTIVOS
Los reactivos de fase sólida empleados en la química seca se engloban en dos tipos: las tiras reactivas y las películas multicapa.
Tiras reactivas
Se utilizan para:
-análisis de orina
-autocontrol de la glucemia
-en sistemas de diagnóstico rápido en la consulta médica y a la cabecera del enfermo.
Consisten, básicamente en un soporte de plástico que sirve de soporte a una matriz de celulosa que contiene los reactivos secos necesarios para que se produzca una reacción con el componente a estudiar.
Tira reactiva del sistema Seralyzer (Ames): consiste en una matriz de celulosa impregnada de reactivos secos que se unen a una lamina soporte de plástico; sobre ella lleva una franja código, que tiene como finalidad ser leída cuando se la inserta en el instrumento.
Tira reactiva del sistema Reflotron (Boheringer Mannheim): consta de una lámina soporte al cual se le adhiere el sistema reactivo separado en dos zonas:
-una está unida a la lamina. Incluye una serie de capas destinadas a la preparación de la muestra.
-la otra se encuentra inicialmente separada de la lámina soporte, y se pone en contacto con ella por simple presión cuando se desea que el plasma entre en contacto con los reactivos para desencadenar la reacción; esta zona lleva en su superficie una laminilla transparente a través de la cual se realizara la lectura.
La disposición en dos bloques hace posible que la parte destinada a la preparación de la muestra se puedan llevar a cabo etapas de preincubación o eliminación de interferentes.
Esta tira incorpora también una capa separadora de fibra de vidrio para la obtención de plasma, con lo cual evitamos la centrifugación previa al análisis.
Ventajas de las tiras: al mantener los reactivos deshidratados aportan una prolongada estabilidad al sistema, que puede ser de meses e incluso de uno o dos años.
Películas multicapa o slides
Están constituidas por diferentes capas muy finas, a través de las cuales se van produciendo todas las etapas necesarias para la determinación cuantitativa del analito. Tiene la apariencia de una diapositiva y está constituido por cuatro capas (que incluyen todos los componentes del sistema). El sistema de más amplia implantación es el Ektachem (Kodak).
Capa difusora: sobre ella se deposita la muestra. Lleva sustancias capaces de reflejar la luz, es la superficie reflectante. Homogeneíza la muestra antes de que llegue a la capa reactiva, distribuyéndola por toda la superficie. Retiene células, cristales y pequeñas y grandes moléculas, así la muestra se convierte en un filtrado libre de proteínas, eliminándose las interferencias.
Capa reactiva: pueden ser una o varias, son las que contienen los reactivos.
Capa soporte: está hecha de plástico transparente y sobre ella se depositan todas las demás capas una tras otra. Tiene doble función: servir de soporte y dejar pasar la luz, ya que la lectura se hace por la parte inferior (la opuesta a la de la aplicación de la muestra).
5. INSTRUMENTOS DE MEDIDA PARA BIOQUIMICA SANGUÍNEA
Son tres los sistemas que se emplean actualmente. Dos de ellos trabajan con tiras reactivas: Seralyzer y Reflotron; el tercero trabaja con slides o reactivos multicapa.
Seralyzer (Ames)
Emplea tiras reactivas. Tras aplicarle la muestra de suero se coloca la tira en una plataforma termostatizada a 37º que se introduce en el aparato. Allí es irradiado por un haz de luz que incide sobre la zona reactiva de la tira; allí se produce la reflexión. Los valores de reflectancia son convertidos en valores de concentración.
Reflotron
-Emplea tiras reactivas. Se puede trabajar con sangre total, suero o plasma; ya que incorpora una capa separadora, que consigue la separación de los eritrocitos del plasma.
-Después de aplicar la muestra, la tira reactiva se introduce en el aparato. El plasma pasa al reservorio situado en la parte inferior de la tira; la reacción comienza cuando (por acción del aparato) se presiona la capa reactiva sobre la capa reservorio del plasma.
-La luz reflejada por la zona de reacción se recoge en un detector de medida, que convierte los valores de reflectancia en valores de concentración.
Emplea los slides. Ofrecen medianos y grandes analizadores, cuya finalidad es ser utilizados en el laboratorio clínico.
La muestra de suero se aplica en la superficie del slide por el autoanalizador, luego es transferida a una cámara de incubación. La muestra se difunde a través de las capas, produciéndose la reacción. La lectura se produce por irradiación que incide en la cara inferior del slide. La luz reflejada es recogida por un detector.
Los dos sistemas más difundidos para análisis de orina son: Sistema Clinitek y Sistema Urotron. Ambos incluyen las tiras reactivas y los lectores de tira de orina.
Estructura de las tiras reactivas:
-un soporte (lamina de plástico blanca).
-zonas de papel impregnando con los reactivos, que van fijados al soporte.
-cada zona reactiva tiene impregnados reactivos distintos, de manera que cada uno tomara una coloración diferente cuya intensidad dependerá de la concentración del componente en la orina.
Modo de empleo:
1. Sumergir la tira reactiva en la orina
2. Eliminar el exceso de orina
3. Leer el resultado. Se puede hacer visualmente sobre una carta de colores o empleando un fotómetro de reflexión.
Sistema Clinitek
Se emplea la tira reactiva Multistix-10-SG.
Está preparada para la determinación de diez parámetros:
- Glucosa
- Bilirrubina
- Cuerpos cetónicos
- densidad
- sangre
- pH
- proteínas
- urobilinógeno
- nitritos
- leucocitos.
Esta tira aporta la ventaja de poder hacer la determinación de densidad de la orina sobre una de las zonas reactivas.
Sistema Urotron
Se emplea la tira reactiva COMBUR-9-TEST.
Está preparada para la determinación de nueve parámetros:
- glucosa
- bilirrubina
- cuerpos cetónicos
- angre
- pH
- proteínas
- urobilinógeno
- nitritos
- leucocitos.
VENTAJAS:
- el usuario solo necesita aplicar la muestra al reactivo en fase sólida para iniciar el análisis, que tiene lugar en unos minutos
- no se precisa preparación previa de los reactivos. Son únicos para cada parámetro y desechables.
- Tienen larga estabilidad
- Son fáciles de almacenar.
DESVENTAJAS:
- Su costo es más elevado que el de la química convencional
- No es práctico para laboratorios con gran carga de trabajo, ya que por cada tira solo se puede realizar la determinación de un analito.
UTILIDADES DE LA QUÍMICA SECA
Se pueden hacer todo tipo de determinaciones bioquímicas, electrolitos, enzimas, perfil lipídico y pruebas derivadas.
En los laboratorios clínicos de hoy en día, se emplea esta técnica para el análisis de orina, mediante el uso de la tira reactiva.
CUADRO RESUMEN DE LOS TEMAS 1-6
Fundamentos de las técnicas de centrifugación - es una técnica de separación de particulas que se basa en la distinta velocidad de desplazamiento de las partículas en un medio líquido al ser sometidas a un campo centrifugo; cuando se centrifuga una solución => se rompe la homogeneidad y se produce la separación de solvente y soluto y las 1ªs partículas en sedimentar son las de mayor masa.
Velocidad de sedimentación - es proporcional a la masa de la partícula y esta propiedad nos permite separar partículas de diferente masa => a (+) masa => (+) velocidad de sedimentación.
ge (gravedad efectiva) - es el tiempo que provoca la sedimentación forzada cuando se acelera; para acelerar la sedimentación se puede aumentar la W (velocidad angular); a (+) W => (+) velocidad de sedimentación; la velocidad de sedimentación es util para caracterizar partículas y en concreto se usa un valor que llamamos coeficiente de sedimentación, que es una característica de todas las partículas que nos da información de dicha partícula; conocerlo, nos facilita conocer => tamaño, densidad y forma de las partículas y además nos permite diseñar métodos de aislamiento de partículas.
Tipos de centrifugas:1)- de sobre mesa o baja velocidad o "clínicas": son de pequeño tamaño, no necesitan refrigeración, max.velocidad hasta 10.000 rpm, útiles para partículas grandes (células, precipitados,...)
2)- microfugas: son una variante de la anterior; tubos cortos para volúmenes muy pequeños, no necesitan refrigeración, velocidad mas de 10.000 rpm, para volúmenes pequeños, se usan en biologia molécular.
3)- alta velocidad: velocidad entre 18.000 y 25.000 rpm, necesitan refrigeración, algunas tienen sistema de vacio, útiles para separar fracciones celulares (membranas, orgánulos) pero no sirven para virus ni ribosomas o macromoléculas.
4)- ultra-centrifugas: velocidad a partir de 50.000 rpm, necesitan refrigeración, sistema de vacio; hay 2 tipos => 1.analíticas (analizan las propiedades de la sedimentación, tienen detectores, determinan la concentración de parametros mediante la DO) 2.preparativas (preparar la muestra para luego analizar => aislar virus, macromoléculas)
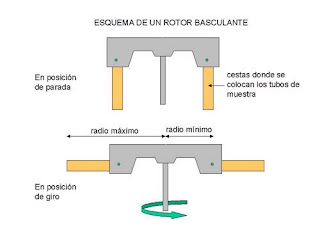
Tipos de rotores:
a)- flotantes o basculantes: posición de 90º con el eje, los tubos utilizados están unidos al brazo del rotor por su parte superior; se usan para volúmenes pequeños de muestra; se utiliza en biología molecular.
b)- de ángulo fijo/angulares: en ángulo fijo (+ o - entre 20-30º con el eje); son para volúmenes mas grandes y se usan en clínica habitualmente;
c)- rotores verticales: se produce en vertical (ángulo 0º); para volúmenes muy grandes; se consigue un "pellet" (sedimento muy poco concentrado); gradiente de densidad isopícnica.
Centrifugación analítica - con esta se pretende estimar propiedades físicas de alguna partícula en concreto, es decir, sus propiedades hidrodinámicas; para esto se tiene que cumplir:
- aplicación en sustancias, en mezclas lo + puras posibles y no a grandes mezclas
- se pueden aplicar velocidades elevadas de giro sin que repercute en la muestra
- rotor utilizado: deben permitir alinear el tubo con los sistemas ópticos que miden la sedimentación en cada momento.
Características:
- poco volumen de muestra
- pureza elevada
- velocidad de giro elevada
- en BQ se utiliza para determinar el coeficiente de sedimentación y saber que particulas, que composición tiene la muestra
- los sistemas ópticos miden la DO de la muestra
Aplicaciones:
- averiguar la pureza de un compuesto
- determinar la proporción relativa de sus componentes
- en investigación => para conocer e interpretar las estructuras moleculares de diferentes compuestos.
Centrifugación preparativa - a diferencia de la anterior, es la técnica que nos permite preparar o adecuar la muestra para su posterior análisis; hay 2 métodos:
A)- Centrifugación preparativa diferencial; es el método mas común de separación que nos permite separar las partículas en función de su velocidad de sedimentación (e.j.sangre); el resultado es la obtención de un sobrenadante y un "pellet" (material sedimentado); es inespecífico, ya que a priori, no se conoce en que fracción va a quedar cada partícula; muy útil para separar células y orgánulos sub. celulares.
B)- Centrifugación preparativa en gradiente de densidad: es mas compleja que la anterior; presenta muchas ventajas ya que permite la separación de varios o todos los componentes de la muestra; en los tubos hay un fluido que de arriba abajo va de menos a mas denso; esto permite separar la muestra por gradiente; la muestra se va colando según su masa y densidad; esto implica la utilización de un soporte fluido cuya densidad aumenta de la parte superior hacia la parte inferior; las características de este gradientes del fluido son:
- material inerte (no altera la muestra)
- que no se vea alterado por cambios de temperatura (resistente)
- que no absorba radiación UV (no interfiera en la medición)
- ser isoosmotico (ni hipo ni hiper respecto a la muestra)
- no ser corrosivo, inflamable
- ser aséptico
- el intervalo de densidad debe ser suficiente
- re-utilizable
Ejemplos de fluidos gradientes que pueden separar las partículas de interés:
- Sacarosa (alta viscosidad => para estudio de proteínas)
- Ficoll (polisacárido de alto peso molécula; menos viscoso que la anterior; para separación de células y orgánulos subcelulares)
- Percoll (menos viscoso que las anteriores; para estudios de fisiología vegetal (micro-algas) y en investigación.
Hay 2 tipos de fluidos - zonal (masa) y isopícnica (densidad)
Zonal - se lleva a cabo mediante un gradiente de densidad y las partículas se separan en función de su masa; a (+) masa (+) velocidad de sedimentación (+) abajo; para proteínas, macro-moléculas, y estructuras subcelulares; características => si parte de la muestra tiene poco peso no podrá con la centrifugación atravesar las zonas mas densas del fluido; cuanto (+) grande => se sedimentara (+) abajo (atravesará las zonas mas densas); la densidad máxima del soporte tiene que ser inferior o como mucho igual a la de densidad máxima de la muestra, porque si es muy denso no podrán atravesar, pero si es muy bajo quedarán apelotonados todas abajo.
Isopícnica - cada partícula se quedará (se coloca) donde encuentra su propia densidad; para lipoproteínas (LDL) según su densidades; características => la densidad máxima del soporte fluido tiene que ser mayor a la densidad máxima de la muestra (porque si la muestra tiene componentes de 15 de densidad y el liquido solo 10, cuando centrifugamos los de 15, 13, 11... quedarán abajo sin separarse).
Definición de gradiente de densidad - es la distribución no homogénea de un fluido en la que concentración del mismo va de menos a mas (columna) consiguiéndose así una distribución gradual de densidad.
Tema 8 - CROMATOGRAFIA
La cromatografia - agrupa un importante y diverso conjunto de métodos que permiten separar componentes que estén estrechamente relacionados en muestras complejas; la muestra a trabajar se disuelve en FM (fase móvil) que puede ser gas o liquido y este FM se hace pasar a través de FE (fase estacionaria) que esta incluida en un soporte que puede ser una columna o una superficie solida; las 2 fases (FM y FE) se eligen de manera que los componentes de la muestra se distribuyen de forma distinta entre ambas; los componentes que se unan fuertemente a la FE se mueven (+) lentamente con el flujo de la FM; los componentes de la muestra débilmente unidos a la FE se moverán rápidamente al ser arrastrados por la FM; Conclusión: la diferente movilidad de los diferentes componentes de la muestra hacen posible la separación de los mismos y esto permite un estudio tanto cualitativo como cuantitativo de la muestra.
MUESTRA (diferentes componentes) => disuelto en FM (fase móvil) de forma gas o liquido => pasar por FE (fase estacionaria) con soporte (columna o superficie solida) => SEPARACIÓN: componentes con (-) afinidad (movilidad RÁPIDA) y componentes con (+) afinidad (movilidad LENTA) => Resultado en BANDAS para su análisis cualitativo y cuantitativo de la MUESTRA.
Ventajas de la cromatografia - son métodos rápidos, simples, tienen un moderado coste, un amplio campo de aplicación como método de separación y ademas, la posibilidad de llevar a cabo un análisis cuantitativo, una vez que se han separado los componentes (cualitativo) en bandas.
Clasificación de los métodos Cromatográficas
Cromatografia de ADSORCIÓN - es la mas antigua (la que se hizo); FE es solida, FM es liquido o gas; la separación depende de la polaridad (según las cargas +/- de las moléculas) de las moléculas de la muestra (soluto); se suelen hacer en columna; las sustancias a separar (muestra) se colocan disueltas en la parte superior de la columna; los distintos disolventes que van pasando por la columna, separar los componentes por la diferente solubilidad de cada uno en el líquido disolvente; tras la cromatografia cada componente eluye en momentos diferentes y así son separados y cuantificados; adsorbentes (FE) => e.j. carbonato cálcico; disolventes (FM) e.j. acetona, metanol, agua. Utilidad => se usa para la separación de diversas sustancias en orina.
Cromatografia de REPARTO - FE suele ser liquido y FM liquido o gas (+ soluble + acuosa); se puede hacer en columna o plana; Rf (factor de retención) => d1 o d2 o d3/ d (es la distancia recorrida proporcionalmente por dicha sustancia d1/d2/d3 dividido entre el frente cromatográfico/ d); permite separar la sustancia según su solubilidad.
Cromatografia de INTERCAMBIO IÓNICO
Las sustancias se separan por el intercambio de iones; se basa en la interacción iónica del soluto con la FE que tiene grupos funcionales cargados; FM suele ser liquido FE solido; se hacen en columna; el soporte (FE) suele ser una resina cargada positivamente o negativamente; si su carga (del soporte) es positiva => la elución (lo que sale de la columna) cargada positivamente y si la columna es negativa => el eluyente sera negativo; para conseguir separar las otras cargas retenidas en la columna, se introduce un tampón de ph adecuado en la columna para que las cargas retenidas se eluyan. Utilidad => en BQ para separar amino ácido, péptidos, proteínas, nucleótidos y todos los compuesto de naturaleza iónica (Hb, isoenzimas).
Cromatografia de PENETRABILIDAD o exclusión MOLECULAR (exclusión por tamaño)
Llamada filtración de geles; se lleva a cabo en gel (como FE) de forma esferas que estén llenos de poros que pueden ser de mayor o menor tamaño según la sustancia utilizada para fabricar el gel; separa sustancia en función de su tamaño y forma (no afecta el eluyente, el pH ni la fuerza iónica); los de mayor tamaño no caben en el poro y pasan por entre las esferas y llegan los primeros; una vez introducidas en el gel, las moléculas mas pequeñas tardaran mas en salir de la red porosa; quedaran retenidas (+) tiempo; Las de mayor tamaño, al no caber en el poro, pasan entre las esferas y eluyen las primeras; a (+) tamaño => (+) velocidad; a (-) tamaño => (-) velocidad (son los últimos en salir, porque se retienen en los poros); Fe es solida (gel) y FM es liquida (puede ser agua o solución electrolítica); la elución solo depende de la forma y tamaño de la partícula. Utilidad => separar sustancias de gran peso molecular (péptidos, proteínas, polisacáridos, ácidos nucleicos, purificación de ciertas sustancias, etc.).
Para realizar estudios - Cromatografia de AFINIDAD
FE es solida (gel) y FM es liquida; Gel recubierto de Ac anti algo (hormonas, enzimas...); metemos la muestra con distinta composición, tenemos Ac anti alguno de sus componentes; los demás componentes eluirán a través de la columna; quedara el Ag y estos podrán salir modificando el ph de la unión.
Utilidad => para saber si hay algunas enzimas, hormonas, vitaminas... (para enfermedades que buscan una de las enzimas o hormonas y que cantidad hay).
Análisis cualitativo (identificación)
Si comparamos la información de la espectroscopia de masas o RMN con la cromatografia, este es limitada; la cromatografia nos da datos del tiempo de retención y de la posición de la sustancia en la FE tras la elución (extracción de una sustancia del medio que le ha adsorbido); los datos de interés se obtienen a partir de cromatogramas obtenidos de una misma sustancia problema, con diferentes FM y a diversas temperaturas de elución; es una técnica muy utilizada para detectar la presencia o ausencia, de determinados componentes en mezclas de las que se conoce su identidad; si en la cromatográfica no aparece el pico de una determinada sustancia, significa que este ausente ( o a concentración inferior); se utiliza para favorecer análisis espectroscópicos posteriores de muestra muy compleja; separación previa para un estudio posterior de las diferentes bandas igual no siempre ha de ser propio al cuantitativo (solo se sabe si hay o no hay estos componentes);
CROMATOGRAMA
Análisis cuantitativo (cuantificar)
Según las técnicas:
- en la cromatografia plana => el área cubierta por las sustancias separadas, las bandas, se recortan, diluyen y en una cubeta se mide la concentración espectrofotometricamente.
- en la cromatografia en columna => la altura o el área de los diferentes picos obtenidos nos dará la información cualitativa al compararlos con determinados patrones.
Para esto se realizan cromatogramas de distintos patrones, obtenidos con diluciones de un patrón cuya composición es similar a la de la muestra problema y se representan gráficamente las alturas o áreas de pico según la concentración; la representación dará una linea recta, luego se comparan los datos de nuestra muestra con la gráfica; los análisis cuantitativos están basados en la gráfica así obtenida.
Cromatografia plana - FE se encuentra extendida en una superficie plana y FM es liquida y se desplaza por capilaridad o por adsorción; 2 tipos =>
1)- Cromatografia en papel (PC) - FE generalmente es liquida, se encuentra adsorbida entre las fibras de una tira de papel; también interviene un proceso de adsorción sobre el soporte solido (cromatografia de reparto); técnica:
- colocar en una tira de papel de filtro una gota de solución de la muestra con un capilar o micro-pipeta (el diámetro no > 5 mm)
- dejar secar
- colocar la tira en una cubeta de vidrio cerrada con eluyente liquido; el proceso puede tener lugar de 2 formas => ascendente (el eluyente sube por el soporte de papel apoyando en el fondo del recipiente) o descendente (el papel se mantiene colgado de la parte superior del recipiente y el eluyente va descendiendo); el descendente es mas rápido, pero no obtienen buenas separaciones;
- dejar que este fluya por la tira de papel (desarrollo del cromatograma)
- al finalizar, sacar la tira de la cubeta señalando el nivel exacto alcanzado por el liquido, secar y proceder al revelado.
Rf = distancia recorrido por la sustancia (d1/d2/d3)
distancia recorrido por el liquido de desarrollo
El valor de Rf esta condicionado por factores => la composición del liquido de desarrollo, la temperatura de realización de técnica, las características del soporte (grosor, tamaño de poro etc.); para considerar el valor de Rf como característico de cada sustancia, es necesario especificar las condiciones en que se ha realizado la medición; es imprescindible estandarizar las condiciones (Ta, pH, etc.)
Revelado con procedimientos físicos => pulverizar una sustancia fluorescente (e.j.fluoresceina) sobre el soporte de papel y al iluminarlo con fuente de luz ultravioleta, se observan las distintas manchas oscuras sobre un fondo fluorescente.
Revelado con procedimientos químicos => pulverizar el soporte de papel con agentes reveladores que den reacciones coloreadas con los distintos componentes de la muestra problema.
La determinación cuantitativa de cada componente se hace mediante fotometría (medida del color de las distintas manchas obtenidas tras el revelado) o someter una mezcla de patrón al mismo desarrollo cromatográfico del problema y comparar los resultados.
2)- Cromatografia en capa fina (TLC) - técnica de reparto liquido-liquido que también interviene un proceso de adsorción; el soporte de FE es un material poroso, pulverulento, extendido sobre una superficie de vidrio, plástico o metal (e.j.celulosa, gel de silice/oxido de aluminio/silicato magnesico, poliamida); FM fluye por capilaridad; es una técnica mas rápida, mas sensible y fiable que PC. Utilidad => separación de sustancias de bajo peso molecular (amino ácidos, lípidos, hidratos de carbono, etc.); se suele hacer de forma ascendente (semejante al PC) y frecuentemente se utiliza la técnica bidimensional, combinando 2 sistemas distintos de disolventes; la elución se realiza mediante el raspado de las distintas manchas en el soporte y posterior extracción con disolventes adecuados; una vez extraídos, se procede la identificación (análisis cualitativo) y su cuantificación (análisis cuantitativo); Drogas => en papel.
Cromatografia en columna - se realiza el transporte de una sustancia a través de una columna por la adición continuada de FM (puede ser liquido o gas); el desplazamiento (por presión o por gravedad) de los distintos componentes de la muestra es decir, su velocidad de migración, depende del tiempo que permanezcan en la FM; el 1er eluyente que sale de la columna es el que tiene (-) afinidad con la FE; FE se encuentra en el interior de la columna; la diferencia de velocidad de los distintos componentes al atravesar la columna permite su separación; el tiempo que pasa desde que se inyecta la muestra en la columna hasta que el pico alcanza el detector => tiempo de retención (tR); el proceso sera mas efectivo cuanto mas separadas aparezcan unas bandas de otras; ensanchamiento de bandas => este efecto no deseable se puede producir durante la separación cromatográfica, lo que disminuye la resolución de la técnica que es la capacidad de una columna para separar 2 sustancias; se produce una difuminación (solapamiento), se mezclan los componentes de las bandas; para evitar, se utiliza columnas de desarrollo suficientemente largas que van a incrementar el grado de resolución cromatográfica y así obtener el máximo rendimiento del proceso (optimización: conseguir que los distintos componentes de una mezcla se separen totalmente y en el menor tiempo posible); técnica =>
(1)- se inyecta la muestra en la columna(2)- adición continuada de FM
(3)- desplazamiento de los distintos componentes de la muestra
(4)- aislamiento de las distintas sustancias que hayan podido separadas (pasar suficientemente FM a través de la columna) hasta que las diferentes fracciones individuales salgan y detectadas por el detector o recogidas
(5)- a la salida de la columna, un detector identificara cada una de las fracciones
(6)- con la señal recogida por el detector se obtiene una gráfica donde aparecen una serie de picos (cromatográfico) que se utiliza para el análisis cualitativo y cuantitativo.
Aplicación => determinación de Hb-glicosilada; separación de sustancia en orina, en BQ => separación de amino ácidos, péptidos, proteínas, nucleótidos, Hb, isoenzimas, polisacáridos; purificación de sustancias, muestras orgánicas complejas, compuestos órgano-metálico.
Cromatografia de gases
La muestra se volatiza y luego se inyecta en una columna cromatográfica; este proceso se lleva a cabo por la acción de un gas inerte (FM) cuya función es la de transportar la muestra a través de la columna; la mas utilizada es la cromatografia de gas-liquido (GLC) con FM gaseosa y FE liquida retenida sobre la superficie de un solido inerte.
Componentes básicos:(1)- Gas portador (FM): químicamente ha de ser inerte, a la presión adecuada y sin agua e impurezas (puede ser => He, N, H, CO2)
(2)- Sistema de inyección de la muestra: volatiliza la muestra; el sistema mas utilizado para la inyección de la muestra es con una micro-jeringa aplicada en la cabeza de la columna
(3)- Columnas de desarrollo: hay 2 tipos => de relleno (empaquetadas) y capilares (tubulares abiertas); hoy en día se utilizan las capilares por su gran rapidez y eficacia
(4)- Sistema de detección: el detector ideal debería tener adecuada sensibilidad, buena estabilidad, gran reproductibilidad, amplio margen de temperaturas, reducido tiempo de respuestas, alta fiabilidad, fácil manejo, no destruir la muestra; los mas usados => ionización de llama, conductividad térmica, termoiónicos, captura electrónica, emisión atómica.
Aplicación => para análisis cualitativo, recurrir a => los tiempos o volúmenes de retención de las sustancias analizadas; para el cuantitativo, se utilizan => los picos o áreas del cromatograma obtenido; las aplicaciones mas importantes son:
- método de separación inmejorable para muestras orgánicas complejas, compuestos órgano-metálicos y sistemas bioquímicos;
- proporcionar un medio adecuado que puede llevar a cabo análisis mas complejos.
Cromatografia de líquidos de alta resolución (HPLC)
Son métodos mas utilizados en la actualidad, que se caracterizan por =>
- permite estudiar líquidos utilizando columnas capilares (+) largas, (-) tiempo para (+) resolución
- su gran sensibilidad
- su capacidad para proporcionar determinaciones cuantitativas exactas
- su gran utilidad a la hora de separar sustancias no volátiles o termo-lábiles
- poder ser utilizados para sustancias de gran interés en la industria en muchos campos de la ciencia
Esta técnica puede ser utilizada para separar => plaguicidas, hidrocarburos, aminoácidos, proteínas, ácidos nucleicos, azucares, drogas, terpenoides (molécula vegetal)
Los componentes básicos:
(1)- sistema impulsor de la FM: debe estar libre de vibraciones para no afectar el flujo
(2)- inyector: en actualidad es un dispositivo que evita las interferencias en la corriente de disolvente
(3)- formador de gradiente (no es indispensable): actualmente con una sola bomba
(4)- columna: material plástico compresible que elimina los espacios muertos de la columna
(5)- detector: 3 sistemas básicos (la absorbancia, el indice de refracción, la fluorescencia
(6)- registro-integrador: se obtiene una gráfica en forma de picos (cromatograma) que identifica las sustancias analizadas y se puede calcular para el análisis cuantitativo.
Tema 9 - ELECTROFORESIS
Electroforesis - proceso de la separación de las especies cargadas de iones o partículas coloidales en función de su distinta velocidad de migración, cuando están sometidas a la acción de un campo eléctrico; velocidad de migración (movilidad electroforética: unidad /tiempo) => la velocidad de desplazamiento de las diferentes sustancias durante el transcurso de la electroforesis; el desarrollo de la técnica electroforética, depende de la densidad de carga y condicionada por una serie de parámetros (pH, fuerza ionica, diferencia de potencial del campo eléctrico aplicado, la naturaleza de la muestra, interacciones entre la muestra y soporte elegido); es una herramienta practica para el analisis de compuestos biologicos y un metodo analítico/preparativo => separa macromoleculas en una mezcla para la posterior tecnicas mas complejas; la sustancia se desplaza en función de su carga y que depende de: (1) la carga de la sustancia (2) el voltaje del campo eléctrico creado (3) el coeficiente de friccion/rozamiento entre el soporte y la sustancia => sustancias (+) se dirigen hacia el polo negativo (cátodo) y las (-) hacia el polo positivo (ánodo);
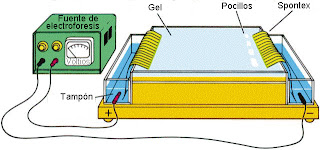
Los componentes básicos de un equipo de electroforesis
- Fuente de alimentación eléctrica: su intensidad en función de las necesidades de la separación de muestras; el voltaje aplicado influye en el resultado de la electroforesis; el calentamiento que se puede generar del aumento del voltaje se soluciona con un sistema de refrigeración.
- Cubeta: donde se coloca la solución tampón; tiene que garantizarse su correcta limpieza
- Puente salino: tiene que estar en contacto con el tampón utilizado, depositado en la cubeta; sobre el colocaremos nuestro soporte
- Tampón amortiguador: fijar pH adecuado => proporciona una fuerza iónica que permite el movimiento de cargas; no se ha de utilizar el tampón para mas de 2 o 3 separaciones; a + concentración del tampón - migración (lenta) => peor separación y resolución.
- Soporte: sobre el donde se coloca/se aplica la muestra con un aplicador y donde aparecen las bandas con las sustancias separadas tras el proceso electroforético; se puede realizar directamente en una solución tamponada (electroforesis libre) o sobre un soporte que permita que las fracciones quedan permanentemente separadas y hacer su cuantificación (electroforesis zonal); la elección del tipo de soporte depende del objetivo del análisis.
- Producto de transparentado (para el acetato de celulosa)- Cubeta de tinción
- Equipo de revelado
- Peine
Las cámaras de electroforesis preferibles son aquellas cuyo tamaño es reducido, porque =>
- presentan una menor superficie de evaporación
- las diferencias de temperatura se minimizan entre un compartimento y otro
- permiten una reducción del tamaño de las aplicaciones y pueden procesar mas muestras al mismo tiempo
Factores que intervienen en el desarrollo electroforético (condicionan su utilidad en el laboratorio):
(1)- carga neta de la sustancia en migración (es el grado de ionización) de las distintas sustancias en la muestra sometida a electroforesis, depende de pH del medio en el que se lleva a cabo todo el proceso (se determina por la utilización del tampón adecuado); es importante en sustancias como proteínas que tienen un carácter anfótero => puede ser (+) o (-); punto isoeléctrico (pi) => valor pH con cargas (+) y (-) es = 0 (cargas neta nula) => sustancia no migra (permanece inmóvil en el punto de aplicación; si pH final > pi => esta cargada (-), la sustancia migrara hacia el polo (+)/ánodo y si pH final < pi => esta cargada (+), migrara hacia el polo (-)/cátodo;
(2)- fuerza iónica del medio - también depende del tampón; la corriente eléctrica es transportada por todos los iones presentes en la muestra y en el tampón; cuando mas concentrado el tampón, mas corriente transportada por los iones de el y menos sera la transportada por la muestra (migra mas despacio); la concentración del tampón debe ser suficiente para mantener constante pH adecuado y proporcionar fuerza iónica que permita el movimiento de cargas => si es > a la requerida => la migración de las sustancias en la muestra sera mas lenta (no se consigue la separación deseada)
(3)- estructura y el tamaño de la sustancia - es importante en aquel proceso electroforética que selecciona las moléculas en función de su tamaño => retiene las partículas mas grandes y deja pasar la pequeñas.
(4)- potencial del campo eléctrico aplicado durante el proceso- cuanto mas potencial eléctrico aplicado => mas la movilidad electroforética de una sustancia; aun así, aumentar el voltaje para acelerar el proceso electroforético puede también aumentar la temperatura y puede causar => alteración debidas al calor (las proteínas plasmáticas se desnaturaliza por el calor) y evaporación del tampón utilizado (queda + concentrado y aumenta su fuerza iónica => dificulta el desarrollo electroforético)
(5)- soporte - se emplea en electroforesis zonal => al final del proceso las fracciones quedan permanentemente separadas y sea fácil proceder a su cuantificación (electroforesis libre => se realiza directamente en una solución tamponada); tipos de soporte (depende del objetivo del análisis) => no restrictivos: acetato de celulosa y gel de agarosa (se usa en diagnósticos clínicos); su separación electroforética solo se hace en función de su carga eléctrica (aun así, las sustancias con elevado peso molecular se ven frenadas o no se desplazan totalmente); restrictivos: gel de almidón y gel de acrilamida/ poliacrilamida (ofrecen alguna resistencia en proceso que depende del tamaño de los poros del soporte, del tamaño y características estructurales de la sustancia muestra); proporcionan buenas separaciones de las fracciones.
-Acetato de celulosa: su estructura deja gran cantidad de huecos de aire; cuando se sumerge en el tampon estos huecos se llenan y el tampón es el encargado de transportar la corriente eléctrica por el soporte y se produce la electroforesis; "el cellogel" es el mas usado; ventajas => fácil manipulación, rapidez de ejecución, elevada productividad, fácil lectura; desventaja => es material opaco y puede hacer desaparecer las bandas mas débiles al transparentar-lo; no es del todo uniforme en su porosidad; puede producir distorsiones en el trazada electroforética; puede producir efectos hipercrómicos (no debidos a la muestra);
-Gel de agarosa: tiene elevado tamaño de poro, formado por agarosa; ventajas => mayor solución (por la uniformidad de los poros que favorece la misma velocidad del desplazamiento => banda homogénea y nítida), ausencia de efectos cromatográficos (adsorción/ intercambio iónico), no reacciona químicamente con la muestra, transparencia completa (contiene mucha agua) que evita la distorsión en el trazado y resultados erróneos por efectos hipercrómicos que producen otros medios opacos; carece de cargas eléctricas; no presenta problemas de endosmosis; es adecuados para la cuantificación por densitometría; inconveniente => solo separa en función de las cargas, por su elevado tamaño de poro;
-Gel de almidón: es difícil de preparar (considerable dificultad para obtener un soporte de espesor y porosidad uniforme) y es de preparación extemporánea => desventaja; ventaja => proporciona un mayor numero de fracciones de la muestra a separar que otros soportes.
-Geles de poliacrilamida, ventajas => proporcionan mayor nº de fracciones y mejor resolución en las bandas por lo que se usan en investigación; el tamaño del poro puede variarse según la composición del gel, por lo que pueden separar las sustancias según su carga y tamaño; son químicamente inertes.
(6)- la intensidad y características generales de la corriente eléctrica aplicada - el voltaje aplicado es muy decisivo: mayor voltaje => mejor es la resolución; pero esto puede generar el calor y la evaporación de parte del agua contenida en el soporte y puede deteriorar la muestra; electroforesis convencional sobre gel de agarosa, no tiene este problema, dada la breve duración del proceso (20 minutos y el moderado voltaje; en cambio, los sistemas que utilizan voltajes elevados deben llevar dispositivos de refrigeración que mantiene la temperatura durante todo el proceso.
(7)- el revelado - se puede recurrir a diversos procedimientos, en función de la sustancia y de la sensibilidad requerida; electroforesis de proteínas plasmáticas => utilizan el colorante azul de coomasie que proporcionan mayor sensibilidad y capaz de detectar desde 1/2 micro-gramo de proteína; la utilización de sustancias fluorescentes como la fluoresceina aumenta la sensibilidad hasta 1 nanogramo; la tinción de plata mejora unas 100 x la sensibilidad obtenida con el colorante de coomasie.
Electroforesis de Proteínas
Su realización es posible, porque tienen diferente masa, tamaño, peso molecular (a mas peso molecular (pm) => menos movilidad electroforética), estructura y carácter anfótero (pueden estar cargadas positivo (+) o negativo (-), lo que conseguimos con la influencia de pH).
Se utiliza tampón Veronal (pH 8,6) => todas las fracciones proteicas del suero se encuentran cargadas (-) => aplicando a muestra en el cátodo, migraran hacia el ánodo /el polo (+); procedimiento:
(a)- sumergir 10 minutos las tiras de acetato de celulosa en el tampón(b)- colocar las tiras en el puente de la cubeta de electroforesis, una vez eliminado el exceso de humedad
(c)- proceder al deposito individual de la muestra sobre el soporte, mediante "el aplicador" (micro o macro)
(d)- introducir el puente de la cubeta, en contacto con el tampón depositado en la misma
(e)- tapar la cubeta, conectar todo el dispositivo a una fuente de corriente continua ajustando la intensidad de corriente en función de las necesidades
(f)- transcurrido el tiempo adecuado de migración, desconectar el equipo y revelar las tiras mediante la tinción adecuada que se fije específicamente a la muestra procesada; si la muestra es plasma, saldrá una banda mas (fibrinógeno); si el soporte es de acetato de celulosa, la muestra de suero obtiene 5 bandas => albumina (la que mas migra), alfa-1, alfa-2, beta (cuando el soporte es gel de agarosa, esta banda se divide en 2: beta-1 y beta-2), gamma (es la que menos se desplaza en suero no patológicos/la banda mas ancha).
(g)- proceder a la cuantificación de cada una de las fracciones obtenidas => se puede utilizar el aparato espectrofotometría o densitometría.
Espectrofotometría => recortar cuidadosamente cada una de las bandas obtenidas; introducir cada banda en un tubo con una sustancia capaz de disolverla completamente; realiza la lectura del color (la DO obtenida de cada banda es proporcional a la concentración de la sustancia incluida)
Densitometría => transparentar el fondo de tira mediante una sustancia transparentadora adecuada (importante conseguir el punto optimo de transparentado de las tiras); introducir la tira en un densitómetro, se obtiene una gráfica, en el que aparecen cuantificadas cada una de las fracciones presentes en la sustancia sometida a la separación electroforética; densitómetro (el aparato) produce proteinograma; albumina: la mas abundante y la que migra mas lejos (peso molecular inferior => queda menos retenida); gamma globulina: la banda es mas ancha y la de mayor peso molecular => menos se desplaza; alfa-1globulina: es la menos abundante con peso molecular menos que albumina; si es patológico se ve una alteración en alguna de las bandas; beta globulina: tiene menos peso molecular que alfa-1 y alfa2.
- sumergir completamente las tiras (gel de agarosa o de acetato de celulosa) para evitar burbujas que podrían dar lugar a manchas opacas sobre la tira;
- aplicar la muestra en forma de linea fina, mediante un capilar o un aplicador para evitar el exceso que podría dar lugar a distorsión en el trazado;
- no utilizar el tampón para mas de 2 o 3 procesos electroforéticos
- asegurar el contacto con los electrodos (preferentemente de grafito)
- garantizar la correcta limpieza de la cubeta y de todos los recipientes utilizados
- mantener un estado de hidratación de las tiras (ni demasiada humedad para evitar la difusión de las bandas, ni demasiada sequedad que podría propiciar el deposito de proteínas en exceso)
Otras aplicaciones - de forma semejante a la electroforesis de proteína, también se realiza con frecuencia en el laboratorio, la de otras sustancias de gran interés clínico => lipoproteínas, hemoglobina y otras susceptibles de ionización en función del pH.
Electroforesis de muestras de orina - la detección de la proteína de Bence-Jones => aparece como 1 o 2 bandas en la zona beta-gamma y mas raramente en la zona de alfa-2 o alfa-1; el método electroforético es el procedimiento mas seguro para su detección, ya que el llamado "test de calor" para la búsqueda de esta proteína proporciona aproximadamente 2/3 de falsos negativos y 1/5 de falsos positivos y las tiras reactivas que detectan proteínas en orina no son útiles para el hallazgo de proteína de Bence-Jones.
Interpretación de los distintos trazados electroforéticos - la mayoría se realiza por una persona experta, es suficiente para obtener una interpretación; frecuentemente, se proporciona mayor información sobre la relación entre los distintos trazados o patrones electroforéticos y ciertas patologías; dichos patrones proporcionan información acerca de lo que ocurre en el organismo durante determinados procesos; las enfermedades tienen patrones predominantes, sin embargo, al no ser específicos, no permiten por si solos llevar a cabo el diagnostico.
Electroforesis capilar y su diferencia con la convencional
Electroforesis convencional (explicado anteriormente) => ha sido utilizado durante muchos años para separar especies complejas de elevado peso molecular de interés biológico y bioquímico; se puede utilizar un sistema de refrigeración para evitar el calentamiento (efecto Joule) que se produce al aumentar el potencial eléctrico (así conseguir mas velocidad) que puede afectar negativamente a la calidad de la separación y resolución); el soporte es papel o gel.
Electroforesis capilar => es una técnica alternativa para paliar la dificultad del calentamiento que se produce (efecto "Joule" => la dependencia directa entre velocidad/resolución y campo eléctrico); se utiliza como soporte un tubo capilar con un diámetro interno < a 0,1 mm y longitud entre 50 cm - 1 m; el soporte de la tecnología utilizada ofrecen separaciones con volúmenes de muestra extraordinariamente pequeños (0,1 - 10 nL), con una elevada resolución y rapidez y los resultados son mas fiables; no hay manipulación => todo esta automatizado y digitalizado; se puede aumentar el campo eléctrico sin peligro; la tecnología de la electroforesis capilar permite evaluar de forma cuantitativa cualquier parámetro estable incluido en una muestra liquida; Utilidad => análisis de proteínas, vitaminas, grasas, carbohidratos, pesticidas, análisis genético, iones.
Tema 10 - BIOLOGÍA MOLECULAR
Las técnicas de biología molecular - se aplican en el laboratorio clínico (microbiologia, bioquimica, hematología etc.) para el diagnostico de patologías de origen genetico de las que es conocido el gen causante; se basan en la capacidad de los acidos nucleicos de auto-reconorse => detectar y unirse unica y exclusivamente a su secuencia complementaria; capacidad de auto-duplicarse; se usan en técnicas de transferencia de Southern Blot y de Northern Blot y las técnicas de ampliación de ácidos nucleicos mediante RCP/PCR para el diagnostico de enfermedad infecciosas, análisis de paternidad y un patrón de huellas de ADN;
ADN /acido desoxirribonucleico => una larga molécula única de doble cadena (bicatenario /dicatenario) formada por la unión de 2 cadenas helicoidales de polinucleótidos enrollados a lo largo de un eje común; las cadenas corren en direcciones opuestas; esta en el núcleo; esta formado por cadenas nucleótidos en los que el azúcar (pentosa) es la desoxiribosa y las bases nitrogenadas son la purínicas (adenina, guanina) y pirimidínicas (citocina, timina); situado en el núcleo y forma cromosoma; es donde se guarda la información necesaria para fabricar proteínas; es un código que se traducirá en amino ácidos y luego proteínas.
ARN /acido ribonucleico => es una molécula (con variaciones ARNn, ARNt, ARNr, etc.) formada por una única cadena (monocatenario) helicoidal compuesta de una sucesión de nucleótidos; sale del núcleo (esta en el citoplasma); es la sucesión de nucleótidos, donde el azucar/pentosa es la ribosa y las bases nitrogenada son purínicas (adenina, guanina) y pirimidínicas (citocina y uracilo); no forma cromosoma; es el encargado de transmitir la información que guarda el ADN (intermediario para la síntesis proteínas).
Hibridación de ácidos nucleicos - consiste en la fijación "in vitro" de ADN o ARN marcada (en la mayoría con un isotopo radioactivo, sustancia química o enzimas) a su correspondiente cadena complementaria procedente de la muestra biológica perteneciente al paciente; esta técnica se basa en la capacidad de los ácidos nucleicos de autor-reconocerse => detectar y unirse única y exclusivamente a su secuencia complementaria; reactivos necesarios: (1) acido nucleico diana de la muestra (2) sondas de hibridación => fragmentos de ácidos nucleicos marcados, se elaboran en el laboratorio y su secuencia de bases es complementaria a la secuencia genómica del ADN diana.
Los sistemas de marcaje de sonda o sistemas indicadores - sistema mediante los cuales se marca la secuencia génica => para poder visualizar una secuencia de ADN/ARN conocida y facilitar el posterior sistema de detección de la enfermedad determinada y lectura de resultados; esta secuencia de ADN es la que se busca en la muestra del paciente, son especificos porque contienen una secuencia de bases que es complimentaria a la secuencia genómica del DNA diana; tipos de sonda:
a. Químico - la sonda se une a sustancias químicas
b. Radioactivo - se incorporan a la estructura molecular de la sonda isotopos radiactivos
c. Enzimático - se une la enzima y la secuencia de acido nucleico mediante una cadena carbonada
d. Antigénico - se dota a la secuencia de la sonda de capacidad antigénica modificando alguno de sus nucleótidos
e. Colorimétrico - se une la sonda a compuestos coloreados o capaces de formar compuestos coloreados; Bromuro de Etidio => se usa como marcador rápido de ADN, que tiene la capacidad de intercalarse en las cadenas de ADN, y al incidir con luz UV emite una luz rojiza anaranjada que es mayor cuando este unido el ADN (sirve para detectar el ADN).
Técnicas de hibridación
(1) Extracción del acido nucleico/ purificación de ácidos nucleicos (técnica del fenol-cloroformo) => se dispone en el mercado de sistemas de aislamiento de ADN a partir de sangre periférica o de células en suspensión (leucocitos) para la obtención de ADN puro; técnica de extracción:
- lisis celular => romper la membrana celular y nuclear con solución de lisis celular (mediante la acción del reactivo y incubación)
- desproteinización => quitar todo lo que no sea material genético con la técnica de fenol-cloroformo; las proteínas parcialmente degradadas, se eliminan de la disolución mediante una extracción con fenol-cloroformo (mediante aplicación de reactivo, centrifugación y decantación repetitivo)
- comprobación de la efectividad de la desproteinización (mediante lectura de absorbancia por espectrofotometría) => se calcula la relación de absorbencias a las 2 ondas y la relación optima oscila entre 1,6 (260) y 2 (280); es para comprobar si la muestra es pura.
Aplicación => diagnostico de leucemia mieloide crónica (LMC) y talasemias
(2) Técnica de Southern Blot - fases:
- purificación de ácidos nucleicos con técnica de fenol-cloroformo => obtener ADN puro
- digestión del ADN por EdR: incubación de ADN o ARN de la muestra con EdR (endonucleasas de restricción => enzimas que seccionan la cadena); objetivo: romper el ADN en diversos fragmentos; se incuba la EdR con el ARN a 37oC y se comprueba la efectividad del proceso, disolviendo una pequeña cantidad de ADN en azul de bromofenol y realizar una electroforesis en un minigel de agarosa => se observan sus fragmentos bajo la luz UV (se obtienen diferentes fragmentos de ADN con regiones diana);
- separación de los fragmentos de ADN: disolver el gel de agarosa;
- desnaturalización del gel: mezclar el gel de agarosa con diferentes soluciones de desnaturalización, centrifugar y decantar el sobrenadante hasta que quede limpio; desnaturalización del ADN => separar las dos hebras de ADN para poder juntarse con el híbrido (en un medio astringente para que no se unan entre ellas) mediante calor (alerta: no fundir el gel porque se estropea el ADN).
- electroforesis (para separar los fragmentos por tamaño); en gel de agarosa o poliacrilamida.
- transferencia a un filtro de nitrocelulosa: hacer pasar el gel por una batería de solución de elevada fuerza iónica => afinidad por el ADN; fija las bandas a un soporte mas estable antes de la hibridación; Por absorción, por capilaridad, ascienden las bandas al papel de nitrocelulosa que es muy resistente y manejable (fijadas para siempre).
- prehibridación e hibridación de ácidos nucleicos: la unión de las sondas marcadas (con isotopos radiactivos) con el ADN diana desnaturalizado (para marcar la secuencia génica, si esta o no); se realiza en una cámara de hibridación con condiciones controladas de temperatura a 42ºC, pH, humedad, concentración de sales, medio astringente etc; se uniran a la sonda, no entre ellos;
- lavado y revelado: una vez acabado el proceso de hibridación, se elimina el exceso de radiactividad con un lavado de filtros (para quitar el exceso de radiacividad), se procede el secado, se pone en contacto con la pelicula radiografica; unos dias despues revelar la pelicula y lectura de resultados segun el metodo de marcaje usado. Presencia o ausencia del fragmento de acido nucleico responsable de la enfermedad genetica y se realiza la lectura de los resultados.
La detección /lectura de los resultados:
- marcaje químico => mediante quimioluminiscencia (se mide la luz emitida por las sondas de la muestra con espectroscopia de luminiscencia)
- marcaje radiactivo => autorradiografía recuento de centelleo (medir la cantidad de radiactividad emitida por la muestra; p.e. isotopos 32P, 125I)
- marcaje enzimático => espectroscopia (se añade al medio un sustrato cromógeno que al reaccionar se convierte en producto coloreado; a mas color, mas cantidad de muestra; el color es lo que se busca)
- marcaje antigénico => espectroscopia y microscopia (Ac contra ese Ag que esta marcada la sonda; el Ac estará marcado con fluorescencia)
- marcaje colorimétrico => espectroscopia (lectura de la DO absorbida por la muestra)
Aplicación => detección de talasemias alfa, reordenamiento de genes, varias patologías.
Astringencia => el grado de interés o afinidad de la sonda por su acido nucleico diana; cuando las condiciones del ensayo son optimas => aumenta su nivel.
Digoxigenina => es una sustancia capaz de reaccionar químicamente y formar compuestos coloreados; se une a la sonda de marcaje; es un marcador antigénico, químico y colorimétrico.
Bromuro de etidio => es un marcador rápido de ácidos nucleicos; es mutagénico y cancerígeno; tiene la capacidad de intercalarse en el ADN cuando se expone a la luz UV, emite un color naranja, rojizo que es mayor cuando este unido al ADN; sirve para detectar el ADN.
Azul de bromofenol => es un indicador de pH, se disuelve en el gel; es usado como frente electroforético, para poder ver (azul) como corre el gel y asegurarnos que las bandas no se salgan (tiene menos peso que el ADN y corre mas).
Western Blot => la misma técnica pero para el estudio de las proteínas; síntesis de determinadas proteínas (enfermedades); se hacen con marcadores Ac anti esa proteína.
EdR (endonucleasas de restricción) => son enzimas (hay + de 100 diferentes) que seccionan una cadena de ADN tras reconocer una secuencia especifica constituida entre 4-8 pares de bases nitrogenadas que delimitan las denominadas zonas de restricción; estos fragmentos se podrían separar y reconocer por electroforesis en gel de agarosa o poliacrilamida y van a ser utilizadas de secuencias de ADN (y ARN) para cortar trozos grandes de ADN en fragmentos mas pequeños; el ARN no se corta porque ya lo encontramos de diferentes tamaños; con la electroforesis los separaremos por tamaño son extraídos de microorganismos; pueden ser romos o cohesivos; en la técnica Northern Blot no se necesitan (no hace falta cortar) ya que el ARN son copias pequeñas de ADN.
Técnica de Northern Blot - es similar a la técnica de Southern Blot; la diferencia es que se utiliza ARN; la composición y estructura del acido nucleico es diferente por lo que las técnicas serán similares desde el momento de la desnaturalización del ADN en la técnica de Southern Blot; muchas veces se trabaja con el ARN porque no se rompe / no se ha de desnaturalizar => son trozos pequeños, no necesitan endonucleasas de restricción.
Ampliación de ácidos nucleicos mediante PCR/RCP (reacción en cadena de la polimerasa)
PCR => es un proceso de amplificación selectiva y enzimática "in vitro" de una secuencia de ADN de hasta 3 kb; es una técnica de gran especificad y sensibilidad, pero puede dar un falso negativo si la muestra esta contaminado; el proceso del termociclador:
1- extracción y purificación de la molécula de ADN de la muestra problema (lisis celular, desproteinización para obtener ADN puro y comprobación de la efectividad de la desproteinización); ADN diana o target ADN => pocillo
2- desnaturalización de la doble hélice de ADN, mediante la aplicación de calor (se produce la separación de las 2 hebras) para favorecer la unión de los cebadores; el termociclador la desnaturaliza a 90º-95º - 20"; se añaden cebadores en exceso; pocillo => ADN
3- hibridación de las cadenas por separado con los cebadores /primers (40º-60º - 20"), que son cadenas de 15 o 20 nucleótidos que se van a unir al ADN por los extremos opuestos de las cadenas complementarias; son necesarios 2 por PCR, cada uno complementario a una cadena del ADN, se encuentran en exceso de concentración para favorecer el proceso; se obtienen mediante sintetizadores de ADN, una vez conocida la secuencia del ADN diana; pocillo => primers
4- extensión del complejo cebador-ADN mediante la acción de la polimerasa (70-75ºC - 30"); se obtiene a partir de la bacteria termus aquaticus (Taq-P) que es resistente al calor a pesar de ser una proteica; se añaden desoxinucleótidos (dNTP) para ir uniendo y copiando la diana y la Taq-Polimerasa que va a catalizar la reacción de elongación de un cebador fijado en el extremo 3' a una cadena molde de ADN; para ello, une dNTP al extremo 3' del cebador en dirección al extremo 5' del ADN molde; pocillo => Taq-polimerasa + dNTP
5- renaturalización => se baja un poco la temperatura para facilitar la unión/ que se enrosquen (unión de la copia con el ADN diana 45-60º)
6- repetición de los ciclos de extensión hasta que se alcance la dimensión que se había pautado.
7- detección del ADN amplificado por electroforesis o hibridación de ADN.
En los pocillos => ADN diana, primers o cebadores, desoxinucleótidos (dNTP), Taq-polimerasa, tampón y otros reactivos.
Ventajas de la técnica =>
- necesita menor cantidad de muestra y es capaz de detectar cantidades de acido nucleicos muy pequeña del orden nanogramos;
- permite amplificar de manera selectiva y enzimática "in vitro" un fragmento de acido nucleico (ADN/ARN) y hacer copias en un tiempo muy corto;
- permite la detección de una sola molécula de ADN en la muestra problema a pesar de estar mezclada con otras moléculas de ADN diferentes, se consigue fabricar múltiple copias de una secuencia de 1 ADN
Aplicación: Hibridación Ácidos nucleicos => LMC, detección de talasemias, hemofilia, fibrosis quística; Genéticas => diagnostico de enfermedad infecciosa (bacilo de Koch, clamidia, meningitis); Investigación => enfermedad oncológica (han abierto un gran abanico y avance en el estudio de muchas enfermedades; pruebas de paternidad; Conocimiento y tipaje víricas y bacterianas; las tres técnicas van unidas en la PCR; un patrón de huellas de ADN, VIH en fase de incubación, para las donaciones de sangre, paleontologia, antropologia, ciencias forenses, criminologia.
Cebadores - son oligonucleótidos que hibridan con el ADN desnaturalizado que se pretende amplificar en extremos opuestos de las cadenas complementarias; son necesarios 2 cebadores/RCP cada complementario a una cadena del ADN; siempre se encuentran en exceso de concentración para favorecer el proceso; se obtienen mediante sintetizadores de ADN, una vez conocida la secuencia del ADN diana; se seleccionan de manera empírica.
Oligonucleótido - secuencia corta de ADN (grupo de 15-30 nucleótidos)
Nucleósido - es molécula formada por la unión de 1 pentosa con 1 base nitrogenada con enlace covalente
Nucleótido - es la unión de un nucleósido con acido fosfórico (pentosa + base nitrogenada + fosfórico)
Sonda - fragmento de acido nucleicos marcados y formados por entre 15-100 nucleótidos; se elaboran en el laboratorio y su secuencia de bases es complementaria a la secuencia genómica del ADN diana.
Tema 12 - Estudio general del metabolismo de las proteínas
Proteínas - son macro-moléculas de masa molecular elevada, formadas por aminoácidos unidos mediante enlaces peptídicos; pueden estar formadas por una o varias cadenas; son biomoléculas formadas básicamente por C - H - O y N; suelen ademas contener azufre y algunas contienen ademas fósforo, hierro, magnesio o cobre entre otros elementos; son las mas abundantes de las biomoléculas => 50% del peso seco de las células; son sustancias muy versátiles; se forman en el ribosoma a partir de la información suministrada por los genes; la unión de aminoácidos da lugar a:
- oligopéptido: numero de aminoácidos < 10- polipéptido: numero de aminoácidos > 10
- proteína: numero de aminoácidos > 100
"En los enlaces peptídicos, el grupo carbóxilo se une al grupo amino de otro AA y libera una molécula de H2O (agua)".
AAs son compuestos anfóteros (anfolitos) => puede comportarse como ácidos o como bases; cada AA posee un punto isoeléctrico (Pi) característico; al pH de su Pi tienen carácter neutro => no presentan carga neta alguna; a pH fisiologico, el grupo amino se encuentra protonado (-NH3+) y el carboxilo sin protonar (-COO-) => zuitterion; los alfa-aminoácidos pueden representarse por NH2-CHR-COOH, siendo R un radical o cadena lateral características de cada aminoácido; grupos R son muy variados químicamente; 20 aminoácidos forman proteínas (aminoácidos proteicos => esencial/proviene de la dieta y no esencial/sintetizados por el organismo), mientras otros nunca se encuentran en ellas; AA esencial => arginina, histidina, isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptófano y valina; todas las proteínas son cadenas lineales compuestas de algunos de estos 20 aminoácidos;
Clasificación de los aminoácidos - según lo que poseen la cadena lateral
- aminoácidos alifáticos => cadena hidrocarbonada (glicina, alanina, valina, leucina isoleucina)
- aminoácidos aromáticos => posee un anillo aromático (prolina, fenilalanina, tirosina, triptófano)
- aminoácidos azufrados => poseen átomos de azufre (cisteina y metionina)
- aminoácidos hidroxilados => cadenas alifáticas hidroxiladas /mas hidrofilicos y reactivos (serina, treonina)
- aminoácidos ácidos y sus amidas => de naturaleza ácida y sus amidas (ácido aspártico, asparragina, ácido glutámico, glutamina)
- aminoácidos básicos => muy polares (lisina, arginina, histidina)
Alteraciones de aminoácidos:
- aminoacidopatías: errores metabólicos congénitos
- déficit enzimático: fenilcetonuria (falta de fenilalanina hidroxilasa), trastornos del ciclo de urea/hiperamoniemia, albinismo (falta de tirosinasa)
- fallos en el transporte de aminoácidos: cistinuria (fallo en la reabsorción renal o fallo en la absorción intestinal)
Catabolismo de aminoácidos - AA endógeno y exógeno se cataliza mediante transaminación o por desaminación oxidativa, tiene lugar en el higado y en el musculo; cuando se necesitan, AA se utilizan para la síntesis de proteínas/proteogénesis (transaminación) y otros productos biológicos; el destino de la cadena hidrocarbonada es => formación de Acetil CoA para: la síntesis de glucosa (gluconeogénesis), el ingreso en el ciclo de Krebs para la obtención de energía o para la sintesis de grasas/lipogenesis; el grupo amino => cuando no es utilizado para la transaminación es degradado hasta amoniaco (desaminación oxidativa) que el higado transforma en urea (ciclo de la urea) y glutamina; algunos AA son utilizados en la síntesis de productos de gran interés biológico (hormonas, neurotransmisores, enzimas, nucleótidos, etc).
Estructura de las proteínas:
- la estructura primaria: determinada por la secuencia de AA en la cadena proteica (el numero de AA presentes y el orden en que están enlazados);
- la estructura secundaria: es el plegamiento que la cadena polipeptídica adopta gracias a la formación de puntes de hidrógeno entre los átomos que forman el enlace peptídico; se distingue varios tipos de conformaciones => conformación al azar, hélice alfa, hoja beta, giros beta, conformación del colágeno, estructuras supersecundarias;
- la estructura terciaria es la disposición tridimensional de todos los átomos que componen la proteína; es la responsable directa de sus propiedades biológicas; esta determinada por la secuencia de AA (estructura primaria);
- la estructura cuaternaria: proteínas con mas de una cadena polipeptídica (oligomérica).
Clasificación de las proteínas
(1) según su composición: simples => solo aminoácidos (albumina); conjugadas => ademas de AA posee un componente no proteico (nucleoproteínas => acido nucleicos, fosforoproteínas, cromoproteínas/ colorante, glucoproteínas/ hidrato de carbono, lipoproteínas/ lípidos)
(2) según su disposición espacial: fibrosas => cadenas polipeptídicas en paralelo a un eje unidos por puentes di-S e H (colágenos); globulares => una o mas hélices alfa enrolladas sobre si mismas en estructura compacta (hormonas, enzimas, anticuerpos)
(3) según su función biológica: estructurales (colágeno); transporte (albumina, hemoglobina, transcobalamina); catalizadores biológicos (enzimas); mensajeros químicos (hormonas); defensa inmunológica (anticuerpos);
(4) según su localización: hísticas/tejidos; hemáticas/en el plasma.
Proteínas plasmáticas - existe mas de 125 distintas, forman parte de un sistema metabólicamente dinámico; funciones:
- fuente de nutrición para los tejidos (sobretodo la albumina)- mantenimiento del equilibrio osmótico (adecuada distribución hídrica en los diferentes compartimentos del organismo)
- amortiguadores o tampones fisiológicos (regular pH)
- transporte de diversas sustancias (iones, bilirrubina, ácidos grasos, hormonas, fármacos)
- funciones defensivas (gammaglobulinas/ inmunoglobulina/ anticuerpos)
- otras funciones => factores de coagulacion, inhibidores enzimáticos, pro-enzimas, enzimas, etc.
Proteínas totales => la suma de las concentraciones de todas y cada una de las proteínas presentes en el plasma; VN 6-8 g/dl; el aumento => disminución relativa del volumen de liquido plasmática (hipovolemia o deshidratación); la cantidad no varia, sino la proporción entre estas y el nivel hídrico del organismo; la disminución => aumento del volumen plasmático (retención de líquidos), disminución en la síntesis de albumina (alteración hepática, desnutrición), descenso en la producción (hipogammaglobulemias) o aumento de las perdidas (quemaduras internas, síndrome nefrótico) de la fracción de las gammaglobulinas (hipoproteinemia).
Estudio de las diferentes fracciones de proteínas plasmáticas:
- electroforesis => separa física-químicamente y cuantifica las fracciones mas importantes de proteínas plasmáticas obteniendo el patrón electroforética (en acetato de celulosa : albúmina, alfa1, alfa2, beta y gamma globulinas); en cada fracción hay proteínas con movilidad semejante aunque muy distintas en estructura y función; por eso, para obtener mas especificidad usamos la inmunoelectroforesis;
- inmunoelectroforesis => combina la separación electroforética con la provocación de reacciones inmunológicas entre las proteínas y Acs específicos frente a ellas (complejos Ag-Ac); las fracciones proteicas se detectan mediante la aparición de arcos de precipitación; importante cualitativamente por detectar un gran numero de fracciones y detectar inmunoglobulinas anómalas;
- inmunodifusión radial (proteinograma sola no se puede usar para diagnostico, hay que hacer serologia completa) => es una técnica de tipo inmunológico, consiste en colocar el suero a analizar en un pocillo practicado en una placa de agar, impregnada de Ac contra la proteína que se desea valorar (por adsorción cada proteína queda atrapada con su Ac); la reacción entre los dos forma un anillo de precipitación cuyo diámetro es proporcional a la cantidad de proteína presente en la muestra; se cuantifica usando patrones.
Fracciones de proteínas en el plasma
Prealbúmina => la información/el indicador de la nutrición proteica, sobre todo en bebes y prematuros; transporta la vitamina A; no aparece en electroforesis.
Albúmina => 55% de total; esencial en la nutrición; contiene todos los AA esenciales; responsable de presión osmótica (retiene agua); regula equilibrio ácido-básico (tampón pH); transportar sustancias; se une a lípidos formando lipoproteínas; su vida media 15 días.
Globulinas => grupo heterogéneo, formados por proteínas y proteínas conjugados (glucoproteína, lipoproteína); se separan (mediante electroforesis) en 3 grupos alfa, beta y gamma;
- alfa => 14-15% de total; tienden a aumentar cuando hay un daño hístico activo; aparece en muchos procesos/ es inespecifica: traumatismo, procesos malignos, inflamación); de divide en alfa1 (subfracción: alfa1-antitripsina, alfa1-lipoproteínas, transcobalamina, protrombina) y alfa 2 (subfracción: ceruloplasmina, haptoglobina, alfa2-lipoproteínas, eritropoyetina, alfafetoproteina);
- beta => 12-14% de total; es estable, no suele aparecer alterada;
- gamma => 17% de total; son las inmunoglobulina (IgG,IgA,IgM,IgD,IgE)/ Acs de inmunidad humoral; su movilidad electroforética es muy variada (banda ancha en proteinograma); proteína C: reactante de fase aguda (altamente sensible); utilidad de de la proteína C reactiva (PCR) en suero => aunque no sirve como prueba diagnostica, pero ayuda a establecer el diagnostico de inflamaciones agudas, necrosis hísticas (es inespecifica); es fácilmente alterable por un gran numero de enfermedades; nos sirve como complementaria para el seguimiento de enfermedades y ver la efectividad de un tratamiento.
Fibrinógeno => en una electroforesis, migra entre beta y gammaglobulinas; es un reactante de fase aguda; es un precursor de la fibrina (coagulacion).
Alteraciones de las proteínas plasmáticas(1) disproteinemias => alteraciones en la distribución de las fracciones obtenidas tras una electroforesis
- hipoalbuminemia => por síntesis insuficiente (malnutrición/déficit de determinados AA y insuficiencia hepática/fallo en la síntesis de albumina); por eliminación y degradación excesiva (síndrome nefrótico/se pierde albúmina por la orina, alteraciones gastrointestinales/perdida por heces, quemaduras extensas /se pierde por la piel);
- hipo-gamma-globulinemia => disminución de las gamma-globulinas, por deficiencias en el sistema inmunitario;
- hiperglobulinemia (alfa, beta y gamma) => aumento de las alfa-globulinas (en inflamaciones agudas, tumores y necrosis de tejidos); aumento de las alfa y beta globulinas (característico del síndrome nefrótico/enfermedad renal); aumento de las gamma-globulinas (en inflamaciones, hepatopatías, enfermedades de colágeno/artritis reumatoides, esclerodermia/acumulación de colageno/tejido conjuntivo en la piel y otros órganos)
(2) paraproteinemias => presencia en el plasma de alguna Ig anormal y/o de alguno de sus fragmentos; son el producto de una actividad espontanea y excesiva de un "clon" proliferante de linfocitos B (gammapatías monoclonales) que suele ocurrir en: mieloma multiple/ tumor de las células plasmáticas, leucemias y linfomas; y también como consecuencia de diátesis hemorragica, lesiones renales, síndrome de hiperviscosidad;
(3) crioglobulinemias => circulación en plasma de Ig que precipitan al descender la temperatura; causas: trastornos circulatorios en las regiones distales de las extremidades y por inflamaciones de los vasos/vasculitis;
(4) alteraciones de alguna banda (defectos aislados de alguna fracción) => defectos de las proteínas plasmáticas debidos a trastornos de la propia síntesis proteica (hereditario/adquiridos);
(5) alteraciones de la proteinemia total => hiperproteinemia autentica (no causado por hemo-concentración /suele ser debida a un aumento de globulina alfa, beta o gamma; la mas frecuente es de gamma-globulinas; hipoproteinemia => disminución de las 2 fracciones importantes (albumia y gamma-globulinas)
Métodos generales de determinación de proteínas - cuantificación de proteínas en suero y en orina
Proteínas totales => se utiliza el método de Biuret; es determinación colorimétrico directo "in vitro" de proteínas en suero o plasma; fundamento => en disolución alcalina, las proteínas forman con los iones cobre (Cu2+) un complejo coloreado de gran estabilidad, cuantificable espectrofotométricamente; el reactivo contiene CuSO4 (sulfato de cobre) en solución acuosa alcalina; la reacción se produce en los péptidos y las proteínas por la destrucción de su enlace peptídico (liberando los aminoácidos); la reacción se basa en la formación de un compuesto de color violeta (intensidad de color = la concentración de proteínas) debido a la formación de un complejo de coordinación entre los iones Cu2+ y los pares de electrones no compartidos del nitrógeno que forma parte de los enlaces peptídicos; método => 20 lambdas de muestra (suero o plasma) o solución de proteínas + 1 ml de reactivo (mezclar) => dejar reaccionar 10 minutos a temperatura ambiente => medir la absorbancia a 540 nm; reacción de Biuret => complejo de coordinación formado en solución alcalina entre los iones cúpricos y los átomos nitrógeno nucleófilos de cuatro moleculas de Biuret.
Determinación de albumina (metodos de fijación de colorantes)
- fundamento => a un pH acido, la albumina (únicamente) se combina específicamente con el verde de bromocresol para forma un complejo coloreado que se determina fotométricamente; es un metodo colorimétrico;
- determinar a la vez albumina y proteínas totales es fundamental para el estudio del metabolismo proteico;
- detectar las alteraciones del nivel de albumina (proteína mayoría) tienen un interés clínico muy significativo.
Determinación de proteínas totales en orina (metodos turbidimétricos) - el mas utilizado es el del acido tricloroacético; es de gran exactitud y precisión; fundamento => determinan espectroscopicamente, la turbidez debida a la presencia de proteínas.
Proteinograma de algunas enfermedades:
- Cirrosis hepática => la fracción albumina desciende por hepatopatía e insuficiencia hepática y la fracción de gamma globulina aumenta por la cirrosis.
- Síndrome nefrótico (B) => disminución de la albúmina por enfermedad renal (se pierde en orina); hay aumento de las globulinas alfa2 porque se producen mas proteínas para compensar la perdida de proteína renal; descienden las gamma globulina.
- Respuesta inflamatoria crónica (C) => aumento de alfa 2 por los reactantes de fase aguda y de gamma por producción continuada de inmunoglobulinas; disminuye albumina al aumentar las gamma en proporción (pero no por perdidas)
Tema 13 - Estudio general del metabolismo de los lípidos
Lípidos - conjunto de moléculas orgánicas, compuestas principalmente por C , H y O, también pueden contener fósforo(P), azufre(S) y N; se caracteriza por ser hidrofóbicas o insolubles en agua y solubles en disolventes orgánicos (bencina, alcohol, benceno y cloroformo); existen => (1) moléculas esenciales (fuente exógeno), (2) moléculas que requieren ciertas modificaciones para ser funcionales y (3) moleculas no esenciales (se sintetizan sobretodo en el hígado).
Clasificación de lípidos:
1- saponificable => contiene acido graso (AG) como unidades básicas; su molécula formada por una larga cadena hidrocarbonada y un grupo carbóxilo terminal; AG se dividen en saturados e insaturados; AG esenciales no pueden ser sintetizados por el organismo (acido linoleico, acido linolénico y acido araquidónico) => se obtiene por la dieta.
(a) simples (solo contienen C,H y O); acilglicéridos => esteres (unión) de AG con glicerol/glicerina mediante una esterificación; 1 molécula de glicerol puede reaccionar con 1-3 moleculas de AG (mono, di o tri-acilglicéridos); tiene forma solido (grasas) y líquidos (aceites) a temperatura ambiente.
(b) complejos/lípidos de membrana => contiene ademas de C,H y O, también N,P,S o otra biomoléculas (glúcido); fosfolípidos => todas las membranas activas de las células poseen una bicapa de fosfolípidos (fosfoglicérido, fosfoesfingolípidos); glucolípidos => forman parte de la bicapa lipídica de la membrana celular como glicocálix: reconocimiento celular y receptores antigénicos (cerebrósidos, gangliósidos).
2- insaponificables (no tienen AG)
(a) terpenos/terpenoides/isoprenoides => aceites esenciales, el fitol (clorofila), vitaminas A,K y E, carotenoides (pigmentos fotosintéticos) y el caucho;
(b) esteroides => ácidos biliares, hormonas sexuales, corticosteroides, vitamina D y colesterol (componente de las membranas celulares);
(c) eicosanoides/icosanoides => prostaglandinas, tromboxanos y leucotrienos (mediadores del sistema nervioso central, procesos de inflamación y respuesta inmune)
Funciones de lípidos:
- Fuente energética
- Principal forma de almacenamiento de energía a largo plazo en forma de triacilglicéridos (en todas las células, sobretodo en los adipocitos => función lipogénesis y lipólisis)
- Componentes estructurales de las membranas celulares y de las lipoproteínas plasmáticas
- Agentes emulsionantes
- Participan en la regulación del metabolismo mediante sus funciones de segundos mensajeros, transportadores, cofactores, hormonas, vitaminas, prostaglandinas, etc.
- Precursores de otras moleculas como hormonas
- Involucradas en respuesta inmunológica
Triglicéridos (TG) - compuestos formados por la esterificación de la glicerina/glicerol con 3 AG; función principal => trasportar la energía hasta los órganos de deposito y su destino final es que sus ácidos grasos sean almacenados o utilizados como fuente de energía; lípidos almacenados como TG constituyen la principal reserva energética del organismo; son depósitos condensados de energía metabólica; en estado inanición, frió, ejercicio etc., se produce una rápida movilización de los TG que se hidrolizan/lipólisis => el glicerol y AG formados pasan a sangre; TG endogénos: producidos por la síntesis en el higado mediante los AG disponibles y mediante la transformación de los hidratos de carbono; TG exógenos: producidos por la absorción intestinal de las grasas digeridas de la dieta; VN de TG en suero => < 160 mg/dl.
Lipogénesis - se produce en las células, sobretodo las adiposas (adipocitos) => especializados en la síntesis y almacenamiento de lípidos; AG procedentes de la ingesta son esterificados con glicerol para formar triglicéridos; este proceso es estimulada por la insulina => impide la movilización de ácidos grasos al inhibir la acción de las lipasas, favoreciendo la acumulación de triglicéridos.
Lipólisis - consiste en la movilización de los triglicéridos (almacenados en el tejido adiposo) cuando son requeridos como combustible; mediante la lipasa, TG se transforman en AG + glicerol; los AG liberados difunden por la sangre, unidos a la albumina para ser transportados a los órganos diana donde se utilizaran como fuente de energía => ruta catabólica de beta-oxidación (se lleva a cabo en las mitocondrias: AG => acetil CoA => entrar al ciclo de Krebs para obtener ATP); las hormonas implicadas que estimulan la lipólisis => adrenalina, noradrenalina, glucagón, GH (hormona de crecimiento) y adrenocorticotropa.
Colesterol - es un lípido insaponificable; englobado dentro de los esteroides; se transporta en plasma unido a proteínas (formando parte de las lipoproteínas LDL, HDL, IDL, VLDL); función => (1) componente estructural fundamental de las membranas celulares (2) precursor de hormonas sexuales y de las hormonas de la corteza suprarrenal (3) participa en la síntesis de ácidos biliares; fuentes exógenos/de alimentación => supone la 1/3 parte del colesterol del organismo y se encuentra en su mayor parte libre; fuente endógeno => sintetizado en el higado y en el intestino; supone las 2/3 partes del colesterol del organismo.
Lipoproteínas - son complejos macromoléculas esféricos formadas por un núcleo que contiene lípidos apolares (colesterol esterificado y triglicéridos) y una capa externa polar formada por fosfolípidos, colesterol libre y proteínas (apolipoproteínas); sintetizadas en el hígado y en el intestino y posteriormente sufren transformaciones en la sangre y en los tejidos; función => permite la solubilización de los lípidos que posean y los transporta de un lugar a otro en el organismo, para su síntesis, almacenamiento y consumo; los mas importantes cuantitativamente son las lipoproteínas encargadas del transporte de colesterol, TG y fosfolípidos;
la proporción de cada uno de sus componentes determina la propiedades física -química de las lipoproteínas;
Quilomicrones => partículas mas grandes y no presentan movilidad electroforética; sintetizadas en el intestino a partir de TG, C y fosfolipidos; vida media < 30 minutos; función principal: transportar TG exógenos a los tejidos para su catabolismo (utilizados o almacenados); residuos de Quilomicrones /remanente/ desgastados => eliminados por el higado.
VLDL => movilidad electroforética entre gamma y beta-globulina; sintetizada en el higado e intestino a partir de los lípidos exógenos y endogénos (fruto del catabolismo de hidrato de carbono); función: transportar TG endogénos ; degradados por lipoprotein-lipasa => forman IDL y retiradas de la circulación o utilizadas para la síntesis de LDL.
LDL => movilidad electroforética en el grupo beta-globulina; producto metabólico de la degradación de VLDL; sintetizada en el higado e intestino a partir de colesterol libre, fosfolipidos y apoproteínas CyE; función => transportar 80% del colesterol circulante hacia las células de los tejidos (que poseen receptores específicos para las LDL) => utilizado para la síntesis de las membranas celulares y hormonas esteroideas; LDL son metabolizadas en los lisosomas => originan colesterol libre que inhibe la síntesis endógena de colesterol, impide la entrada de colesterol a las células, estimula el proceso de esterificación del colesterol libre del citoplasma;
HDL => movilidad electroforética en el grupo alfa-globulina; sintetizada en el higado e intestino; función => captan el colesterol libre de las células de los tejidos periféricos por la acción de la enzima LCAT (lecitin-colesterol-aciltransferasa);
Lípidos: Q > VLDL > LDL > HDL (de mas a menos)
TG: Q > VLDL > LDL > HDL (de mas a menos)
Proteínas: Q < VLDL < LDL < HDL (de menos a mas)
Colesterol: Q < VLDL < LDL < HDL (de menos a mas)
Fosfolípidos: Q < VLDL < LDL < HDL (de menos a mas)
se clasifican según su densidad (a mayor densidad menor contenido en lípidos) =>
- quilomicrones < 0,95 g/ml
- lipoproteínas de muy baja densidad /VLDL 0,940 - 1,006 g/ml
- lipoproteínas de densidad intermedia /IDL 1,006 - 1,019 g/ml
- lipoproteínas de baja densidad /LDL 1,019 - 1,063 g/ml
- lipoproteínas de alta densidad /HDL 1,063 - 1,21 g/ml
Lipoproteína => parte lipídica + parte proteica (apoproteína); función de apoproteína => como componente estructurales de las LP (contribuyen a la solubilización de los lípidos); como cofactores de diversas enzimas; permiten que las LP sean reconocidas por receptores de la superficie celular.
Metabolismo de las lipoproteínas:
Tras la ingestión de grasas, una vez absorbidas, las células intestinales forman los Quilomicrones (TG, colesterol y fosfolípidos); su función sera la de transportar los TG exógenos a los tejidos a través de los capilares donde por la acción de la lipoprotein-lipasa serán hidrolizados dando glicerol y ácidos grasos; el glicerol sera utilizado para la síntesis de glucosa (glucogénesis) y los AG serán almacenados en los adipocitos o serán transportados por la albumina, (ya que no van unidos a lipoproteínas), a través del proceso B-oxidación para obtener acetil CoA, ingresara en el ciclo de Krebs para obtención de energía; Los residuos de los Q (sin TG) se eliminan vía hepática; las VLDL son sintetizadas sobretodo en higado y su función será la de transportar los TG endogénos que también son degradados por la lipoprotein-lipasa en los capilares, repitiéndose el ciclo explicado anteriormente y va a quedar un remanente rico en colesterol que son las IDL que o bien son retirados al higado o utilizados para la síntesis de LDL. Las LDL formadas se originan por la degradación de VLDL; su función principal es la de transportar el colesterol circulante hacia las células de los tejidos periféricos que poseen receptores específicos para las LDL; Las LDL son metabolizadas y darán colesterol libre que las HDL (sintetizadas en el higado e intestino) van a ir captando de los tejidos periféricos y acumulando en su interior para ser transportado al higado para su degradación o hacia las glándulas endocrinas para la síntesis de hormona esteroides; si hay exceso de LDL, se acumulara en las arterias produciendo ateromas.
Beta-oxidación => constituye una ruta catabólica de los AG en la cual se produce la eliminación secuencial de unidades de 2 átomos de carbono, de manera que se va degradando el AG activado hasta transformarse en Acetil CoA, que entrara en el ciclo de Krebs para la obtención de energía (objetivo); tiene lugar fundamentalmente en las mitocondrias.
Cuerpos cetónicos => se forman en la mitocondria del higado (hepatocitos)/cetogénesis a partir de acetil CoA; su concentración en sangre es baja, su aumento puede ocasionar disminución del pH sanguíneo (acidosis/cetoacidosis); función => en situaciones especiales (ayuno prolongado y diabetes mellitus) es suministrar energía al corazón y cerebro;
Recorrido del transporte de lípidos
Vía exógena => colesterol y triglicéridos (ácidos grasos + glicerol) que proviene de la dieta => forman quilomicrones => pasa a la sangre hasta los capilares del tejido adiposo y muscular => degradados por lipoprotein-lipasa => mono y diglicéridos => entran a la célula; el resto del quilomicron se une a las HDL y captados por el higado; el remanente puede formar ateromas en los vasos sanguíneos;
Vía endógena => VLDL (sintetizada por el higado) ricas en triglicéridos, degradadas por la lipoprotein-lipasa, en estado de ayuno los transporta hasta los tejidos; el remanente es captada por las fracciones de HDL; remanente de VLDL (IDL) tiene un potencial aterogénico y un 50% captado por el higado a través de receptores LDL; el LDL altamente aterogénic contiene principalmente colesterol y la función de transporta-lo a los tejidos que lo requieren (gónadas, glándulas adrenales, células alta tasa de división); Hígado también tiene la función de remover estas LDL a través del receptor LDL. 2/3 de la LDL se remueven de esta forma y el resto en las células de Kupffer, las células musculares lisas y los macrófagos, sin mediar ningún receptor; esta ultima vía se cree que participa en el proceso aterogénico.
Clasificación de las hiperlipoproteinemias - una de las clasificaciones mas utilizadas es la de Fredrickson, modificada posteriormente por la OMS (incluyendo 1 tipo mas); es únicamente descriptiva y no refleja lo ocurrido con la HDL.
Tipo I => aumentado Quilomicrones, Colesterol plasmático y TG plasmático; aspecto de suero turbio/cremoso (reposar en la nevera => se forma una capa cremosa en la superficie y el resto se aclara; significa que hay un exceso de Quilomicrones, así como un aumento de colesterol total y TG)
Tipo IIa => aumentado LDL, Colesterol plasmático; aspecto de suero claro
Tipo IIb => aumentado VLDL, LDL, Colesterol y TG plasmático; suero turbio (no forma costra)
Tipo III => aumentado IDL, Colesterol y TG plasmático; suero turbio (no forma costra)
Tipo IV => aumentado VLDL, Colesterol y TG plasmático; suero turbio (no forma costra)
Tipo V => aumentado Quilomicrones, VLDL, Colesterol y TG plasmático; suero turbio/ lechoso (reposar en la nevera => se forma una capa cremosa en la superficie y el resto no se aclara; significa que hay un exceso de Quilomicrones y de VLDL, así como un aumento de colesterol total y de TG).
Estudio del metabolismo lipídico
A-Alteraciones de las fracciones lipídicas circulantes - relacionada fundamentalmente con la aterosclerosis, ocasionadas por:
1- aumento de las fracciones lipídicas circulantes /hiperlipemias (la mas importante) => hipertrigliceridemia, hipercolesterolemia, aumento de las HDL y incremento plasmático de los AG libres.
2- disminución de las fracciones lipídicas /hipolipemias (menos frecuente); se producen como consecuencia de (1) una disminución en el aporte o en la absorción de nutrientes => malnutridas o síndromes de mal-absorción (2) una síntesis insuficiente de apoproteínas => enfermedad genética (3) un aumento de la degradación de las lipoproteínas => trastornos hormonales/enzimáticos;
la abetalipoproteinemia: trastorno hereditario poco frecuente => no pueden sintetizar la apo-B => no se pueden sintetizar las LP que la contienen (quilomicrones, LDL y VLDL) => descenso plasmático de colesterol y triglicéridos;
un aumento de catabolismo de un tipo de LP => las fracciones lipídicas que transportan esta LP en sangre, disminuye (e.j.catabolismo acelerado de LDL => causa una hipocolesterolemia);
3- aparición de LP de estructura anormal en sangre /dislipoproteinemias
B-Estudio de los trastornos por el deposito anormal de los lípidos en el organismo (no circulante!!) - en las neuronas puede dar lugar a manifestaciones neurológicas diversas y deficiencia mental y en los órganos, aumenta su volumen.
- lipodistrofias: atrofias localizadas del tejido adiposo => reducida respuesta de la insulina (SIDA)
- hígado graso o esteatosis: la síntesis de TG supera la capacidad de transformarlos en VLDL => se acumula exageradamente en el higado (diabetes, alcoholismo);
- lipoidosis: raras enfermedades hereditarias de tipo metabólico => déficit de algunas enzimas encargadas de la degradación lipidica (acumulo de lípidos en los tejidos);
(1) Hipertrigliceridemia
- el aumento de TG a consecuencia de una elevación de la síntesis o de un descenso en la degradación
- en general puede estar causada por => dieta inadecuadas, trastornos hereditarios, manifestación secundaria de otras enfermedades;
- causadas por aumento de la síntesis => aporte calórico, alcoholismo, diabetes/déficit de insulina activa la lipasa, trastornos (mecanismos de actuación complejos - no precisados); debidos a la disminución de la degradación => diabetes, trastornos (fallo en mecanismos del catabolismo de TG); consecuencias => dolor abdominal, hepatoesplenomegalia, formación de xantomas.
(2) Hipercolesterolemia
- el aumento de los niveles de colesterol causado por aumento de la síntesis o a un defecto de la degradación de las lipoproteínas que se ocupan de su transporte (la mayoritariamente un aumento de colesterol de las LDL);
- en general puede estar causadas por => dietas poco equilibradas, herencia, manifestación secundaria de otras enfermedades;
- causadas por el aumento de la síntesis => síndrome nefrótico (estimula la acción de lipoprotein-lipasa), aumento de la síntesis de LDL y ciertas enfermedades hereditarias; debidos a la disminución de la degradación => dietas ricas en ácidos grasos insaturados y colesterol, déficit de hormonas tiroideas, trastornos hereditarios/genético; consecuencias => aterosclerosis, otras (alteraciones corneales, formación de nódulos o placas en parpados y la piel /xantomas) por el aumento de macrófagos cargados de Colesterol.
(3) Aumento de HDL - causados por hiper-alfa-hiperproteinemia familiar, ejercicio físico regular, consumo de alcohol moderado, mujeres (cantidad de estrógenos); consecuencias => aumento de HDL protege el desarrollo de la aterosclerosis (HDL retiran el colesterol de los tejidos y la pared arterial hasta el hígado para su eliminación).
(4) Aumentado de los ácidos grasos libres - AG libre son transportados por la albumina; aumentan cuando hay hiper-secreción de hormonas /catecolaminas => activan la lipasa => lipólisis en el tejido adiposo; causas => situaciones de estrés (aumentan las catecolaminas/produce AG), neoplasia de la médula adrenal con secreción de catecolaminas, ayunas y diabetes; consecuencias => AG libres son captados por el hígado => aumentar la producción de cuerpos cetónicos y VLDL;
Valor normal de colesterol total < 200 mg/dl (leve 200-249, moderada 250-299, grave >299)
Valor normal de c-HDL en hombres > 37 mg/dl; en mujer > 47 mg/dl
Valor normal de c-LDL optimo < 100 mg/dl; aceptable 100-129 mg/dl
Valor normal de TG/triglicéridos < 160 mg/dl (limite de alto riesgo 160-199, alto riesgo 200-499)
Investigación en el laboratorio de las dislipemias
Dislipemias - conjunto de alteraciones patológicas que afectan al metabolismo de los lípidos, caracterizadas por alteración de los niveles normales de lípidos circulantes;
Metodos de exploración selectiva - estudio de aquellas personas que:
- son consideradas de alto riesgo, en base a sus antecedentes familiares de enfermedades cardiovasculares o a la presencia de hipercolesterolemia en un familiar en primer grado;
- presentan una gran probabilidad de sufrir una hiperlipemia, asociada a otras alteraciones metabólicas (hipertensión, diabetes, enfermedad renal crónica, etc.)
Fuentes de error que podrían impedir un diagnostico correcto => un tratamiento inadecuado:
- Biológicas: existen diferencias apreciables en los niveles lipídicos en función del sexo, la edad, la raza.
- Socio-ambientales: dieta, obesidad, consumo de sustancias toxicas (tabaco, alcohol), ejercicio físico.
- Manipulación de la muestra: ayuno previo a la recogida, anti-coagulantes, almacenaje, transporte
- De tipo clínico: tratamiento farmacológico, embarazo, enfermedades concurrentes.
Condiciones pre-analíticas (previas a la extracción)
- ayuno mínimo 12 horas
- durante 2/3 semanas el paciente ha de mantener su dieta y estilo de vida normal
- evitar el ejercicio intenso 3 horas antes
- suspender cualquier medicación como estrógenos, anticonceptivos orales, salicilatos (al menos 1 mes antes)
- si el paciente ha tenido una enfermedad leve retrasar la extracción 3 semanas
- si el paciente ha tenido una enfermedad grave retrasar la extracción 3 meses
- confirmar el diagnostico, repitiendo la prueba 2/3 x durante 2/3 semanas
Condiciones de la muestra
- utilizar siempre suero, si usamos plasma que sea con EDTA
- tras 48 horas realizar la determinación de triglicéridos y colesterol???
- si queremos separar lipoproteínas, añadir una solución conservante a la muestra y se tiene que determinar 3/4 días después de la extracción???
- conservar la muestras refrigeradas a 4oC
Metodos diagnósticos para el estudio de los lípidos
A- Metodos generales: el objetivo es determinar las alteraciones orgánicas generales de una dislipemias.
En laboratorio general:
(1) Análisis del colesterol y los TG totales => mediante metodos enzimáticos
(2) Análisis del colesterol HDL => se determina tras la precipitación del resto de las lipoproteínas (que contienen apo-B) con reactivo policatiónicos; el HDL se determina en el sobrenadante, por metodos enzimáticos.
(3) Detección de quilomicrones => se determina por el aspecto lechoso y opalescente del mismo; en estos casos se confirma su presencia dejando el suero toda la noche a 4ºC de manera que forman una capa cremosa flotante.
(4) Análisis del colesterol-LDL => estimar el c-LDL (disponiendo de los datos de colesterol total, triglicéridos y c-HDL) mediante la formula de Friedelwald, siempre que las cifras de TG sean inferiores a 200 mg/dl (cuando TG > 200mg/dl, la aplicación de esta formula implica importantes errores de valoración); la formula => c-LDL = colesterol total - TG/5 - c-HDL
(5) Determinación de apoproteínas AI y B => esta prueba se ha incluido recientemente, debido a que existe una fuerte relación entre la presencia de estas apoproteínas y las enfermedades cardiovasculares; aumento de la apo-B => aumenta el riesgo de enfermedad cardiovascular; disminución de la apo-AI => factor de riesgo de cardiopatía isquémica.
En laboratorio especializado - se realiza mediante la separación de las distintas fracciones de lipoproteína (por cualquier metodos) => se determina Colesterol, TG, fosfolipidos y proteínas; metodos de separación => 1-método combinado, 2-ultracentrifugación secuencial, 3-ultracentrifugación en gradiente de densidad => se lleva a cabo en un único ciclo de ultracentrifugación, gracias a un gradiente continuo de densidad, a lo largo del tubo; cada LP flota a la altura correspondiente a su densidad.
B- Metodos específicos - el objetivo es el diagnostico origen genético de las dislipemias primarias (estudio genético): muy especificas, encaminadas al diagnostico de una dislipemia concreta (determinación de apo-B => ante niveles de LDL disminuidos y TG normales o disminuidos, se deben determinar los niveles de apo-B para descartar una hipo o abetalipoproteinemia.
Tema 14 - Estudio general del metabolismo de
los hidratos de carbono
Concepto de metabolismo y ruta metabólica (anabólica - catabólica)
Metabolismo - conjunto de todas las transformaciones químicas que se producen en una célula o en un organismo; rutas metabólicas => reacciones catalizables enzimáticamente que convierte un precursor (sustrato inicial) en producto final (para utilizar o desechar) a través de diversos intermediarios metabólicos/ metabolitos; reacciones catabólicas => degradan biomoléculas y obtienen energía que sera usada en las reacciones anabólicas para sintetizar/fabricar biomoléculas; todos los procesos transcurren de manera conjunta en el espacio (la mitocondria) y en el tiempo, comparten en muchas ocasiones intermediarios y mantienen un equilibrio dinámico entre las 2 rutas para mantener la estructura y las funciones del organismo.
Rutas anabólicas (divergentes) => reacciones químicas para sintetizar moléculas grandes y complejas (polisacáridos, proteínas) a partir de precursores sencillos (amino ácidos o glucosa) con un gasto de energía/intercambio protones (en forma de hidrólisis de ATP o consumo de poder reductor/ oxidado); la utilización del ATP es termodinamicamente desfavorables; estas reacciones se aceleran en cuatro ocasiones => durante periodos de exceso relativo de energía, en periodos en que hay una gran asequibilidad de moléculas precursoras, en periodos de crecimiento y regeneración de material celular.
Rutas catabólicas (convergentes) => reacciones químicas que rompen/degradan de manera secuencial los combustibles ingeridos o almacenados como glúcidos lípidos o proteínas y los convierten en moléculas mas pequeñas (CO2 y H2O en ultimo termino), que producen energía en forma de ATP y poder reductor que es almacenable o consumible (en este proceso consumen frecuentemente oxigeno - son procesos de degradación oxidativa); este tipo de procesos se aceleran en los periodos de falta de combustible o de estrés en un organismo; se dividen en 3 etapas:
(1) Hidrólisis de las macro-moléculas (polisacáridos, lípidos, proteínas) => se obtienen los monómeros o las subunidades (monosacáridos, disacáridos, ácidos grasos y glicerol, aminoácidos) que los constituyen.
(2) Catabolismo de los monómeros o subunidades (se realiza en las mitocondrias) => los convierten en/ se produce acetil coenzima A (acetil CoA).
(3) Oxidación total => formada por 2 rutas metabólicas: (1)-ciclo de acido cítrico / ciclo de Krebs (produce NADH + oxida el acetilCoA => CO2); (2)-fosforilación oxidativa (produce ATP que se regenera en => NAD+) y transporte de electrones reduce el O2 => H2O; producto desecho => CO2 + H2O + NH3 (amoniaco - va al riñon en forma de urea => transformado en el higado).
Las rutas de biosíntesis/ anabólicas no son las inversas (son irreversibles) de las rutas catabólicas.
Metabolismo energético - las 2/3 partes del oxigeno que inspiramos, se utilizan en los procesos oxidativos mitocondriales (respiración celular); función de Acetil CoA en el metabolismo => es la forma en que el ciclo de Krebs acepta la mayoría del combustible aportado, aunque pueda seguir otros destinos (como precursor en biosíntesis); formación de Acetil CoA (en la mitocondria):
(1) Polisacáridos (dieta) o Glucógeno (reserva en hígado/musculo) + glucólisis/ glucogenólisis (vía glucolítica) => glucosa => piruvato + oxidación => acetil CoA
(2) Lípidos (dieta) o triacilgliceroles/ triglicéridos (reserva en higado/tejido adiposo) + lipólisis => ácidos grasos libres + beta oxidación => acetil CoA
(3) Proteínas (dieta) + proteólisis => aminoácidos + transaminación/ desaminación y oxidación => acetil CoA.
Destinos de acetil CoA:- en la mitocondria => oxidación completa del grupo acetil en el ciclo de Krebs => energía
- en el hígado => síntesis de cuerpos cetónicos (acetona, acetoacetato y beta-hidroxibutirato), cuando el ciclo de Krebs esta saturado
- en el citoplasma => la transferencia de las unidades acetil (como precursor de las moléculas) y la posterior biosíntesis de esteroles, ácidos grasos, aminoácidos, acetil colina, colesterol, gluconeogénesis.
Hidratos de carbono/ carbohidratos/ glúcidos/ sacáridos/ azucares => compuestos orgánicos formados por C, O, e H; su formula empírica es (CH2O)n; se clasifican según su numero de molécula:
(a) monosacáridos => contienen 1 única molécula de azucar e.j. glucosa/dextrosa C6H12O6 (azucar de uva), fructosa (azucar de caña o de remolacha), galactosa (azucar de leche); en solida es blanco; muy solubles en agua e insolubles en disolventes no polares; la mayoría son dulce; puede ser => aldosas y cetosas (aldehido o cetona), formas D y L, formas alfa y beta;
disacáridos => compuestos por 2 moléculas de azucar sencillo por enlace glucosídico en el que se desprende una molécula de agua; sacarosa (azucar de mesa) se obtiene de glucosa y fructosa; lactosa (azucar de leche) se obtiene de glucosa y galactosa; maltosa (producto de degradación almidón + amilasa) se encuentra en la cerveza;
(b) oligosacáridos => formados por entre 3-10 moléculas de azucar sencillo
(c) polisacáridos => formados por la unión de 11 a cientos de miles de azucar sencillo
Clasificación según su función biológica:
(1) polisacáridos de reserva => almidón (vegetales) o glucógeno (animales)
(2) polisacáridos estructurales => celulosa (vegetales) y quitina (hongos / artrópodos)
(3) otras funciones => reconocimiento celular (MHC), protección frente a condiciones adversas (capsulas en microorganismos) y adhesión a superficies (biopelículas) como pegamento
Clasificación según su composición:
- homopolisacáridos => repetición de un monosácarido
- heteropolisácaridos => repetición ordenada de un disacárido formado por 2 monosacáridos distintos (alternancia de 2 monosacáridos); algunos participan junto a polipéptidos (peptidoglucanos, muco-polisacáridos o proteoglucanos);
Fuentes de glúcidos en el organismo:
Dieta => ingeridos en forma de polisacáridos (almidón) y disacáridos (sacarosa, fructosa), una vez digeridos, son absorbidos en forma de monosacáridos; los que son absorbidos diferentes a la glucosa, se transforman en glucosa en el hígado .
Síntesis endógena => gluconeogénesis (formación de glucosa a partir de precursores no glucídicos => a partir de aminoácidos, acido láctico, piruvato y glicerol) tiene lugar en el hígado (90%) y en el riñón (10%) y necesita enzimas específicos mitocondriales y citoplasmáticos y suministro energético en forma de ATP y GTP (ruta anabólica); es esencial para regular la glucemia (el cerebro utiliza 20% del gasto de glucosa del todo el cuerpo).
GLUCONEOGÉNESIS
VÍA DEL SORBITOL
Funciones de los hidratos de carbono:
(1) Fuente de energía (la mas importante) - obtenida de la degradación de moléculas de glucosa => monosacáridos, mediante diferentes vías metabólicas:
- vía de glucólisis en citoplasma (la ruta mas importante cuantitativamente): degradación de 1 molécula de glucosa (por la acción de enzima glucolítica) => se obtiene 2 moléculas de piruvato + oxidación => acetil CoA que entra al ciclo de Krebs (aerobiosis) => da lugar a 36 moléculas de ATP; en el proceso anaerobiosis el piruvato => cuerpos cetónicos;
- vía de las pentosas fosfato: se obtiene ribosa (fundamental en la síntesis de ácidos nucleicos/ruta anabólica) y también NADPH/poder reductor (molécula necesaria en muchos procesos metabólicos del organismo).
- vía del sorbitol: se obtiene fructosa (exceso de glucosa entrar a las células ricas en aldosa reductasa e.j. cristalino, células de Schwann, células endoteliales => se transforma en polialcohol/ sorbitol (toxico) + enzima sorbitol deshidrogenasa => fructosa);
(2) Reserva energética - esta función la desempeña el glucógeno mediante el proceso glucogenogénesis por el exceso del aporte glucosa/ aumento de glucemia; este tiene lugar en el hígado (en el proceso glucogenólisis => se obtiene energía para todo el organismo) y en el musculo (el proceso glucogenólisis => se obtiene energía solo para los músculos); en el proceso de glucogenólisis, se necesita fundamentalmente => enzima glucógeno fosforilasa y enzima desramificador;
(3) Servir de base para la síntesis de estructuras como ácidos nucleicos (a partir de ribosa que se obtiene por la vía de las pentosas fosfato).
VÍA DE PENTOSAS FOSFATO
Metabolismo de la Glucosa - es importante la homeostasis de glucosa en la sangre/ glucemia a través de rutas catabólicas (glucólisis y glucogenólisis) y rutas anabólicas (gluconeogénesis a partir de las proteínas y glucogenogénesis).
- glucemia en ayunas (VN) => 60-100 mg/dl, tras la ingerida (postprandial) se elevan a 120-150 mg/dl o mas; en persona normal este nivel descienden rápidamente y vuelve a alcanzar el nivel basal; glucemia no se debe dejar por debajo de 50-60 mg/dl;
- con una función renal normal, aparece glucosuria cuando la glucemia es > 160 mg/dl (umbral renal para glucosa); si el túbulo renal esta dañado, puede aparecer glucosuria con glucemia normales; en condición normales, el túbulo renal reabsorbe la glucosa en su totalidad (no tiene que haber glucosuria);
- el metabolismo de la glucosa se regula mediante la insulina y un conjunto de sustancias de acción antagónica/ contra-insulares (glucagón, glucocorticoides, catecolaminas y hormona del crecimiento); el hígado almacena unos 100 gr de glucógeno para la necesidad del organismo durante 4 horas;
función de insulina (hormona hipoglucemiante): el aumento de glucemia => estimula la producción de insulina que a su vez estimula => captación de glucosa por las células del musculo esquelético y las adiposas => se utilizara como combustible o reserva glucógeno (glucogenogénesis a nivel hepático y muscular); insulina también disminuye gluconeogénesis del ácidos grasos (estimula el almacenamiento en el tejido adiposo/ lipogénesis => acumulo de triglicéridos) y aminoácidos (promueve síntesis de proteína/ proteogénesis a nivel muscular);
función de glucagón: promueve glucogenólisis (degradación de glucógeno), gluconeogénesis (moviliza ácidos grasos y aminoácidos como combustible) y cetogénesis (síntesis de cuerpos cetónicos); moviliza ácidos grasos (lipólisis), aminoácidos (proteólisis) y glucosa (glucólisis) como combustible;
*** la secreción de insulina y de glucagón (por parte de páncreas) esta controlada por el nivel de la glucemia;
glucocorticoides (cortisol): sustancia contra-insular (antagónica a la insulina); son compuestos esteroides sintetizados por la corteza suprarrenal; estimulan gluconeogénesis y lipólisis;
catecolaminas (adrenalina): compuestos contra-insular (adrenalina y noradrenalina) estimula glucogenólisis, lipólisis y inhibe la secreción de insulina;
GH/ somatotropina (hormona del crecimiento): genera la resistencia a la acción de la insulina; estimula lipólisis; su antagonista es somatostatina (inhibidora de GH)
Alteraciones en el metabolismo de los hidratos de carbono - el metabolismo de la glucosa es defectuoso en 2 enfermedades importantes en la practica clínica => la obesidad y la diabetes que se puede desarrollar hacia => arteriosclerosis, hiper-tensión, las enfermedades de vasos capilares, del riñón y la ceguera.
(a)- Hipoglucemia => glucemia < 45-50 mg/dl acompañada o no de signos clínicos; desequilibrio causado por el consumo de glucosa por los tejidos; manifestaciones clínicas => aumento de liberación de adrenalina (grupo catecolaminas) y disfunción del sistema nervioso central (es importante que estos remiten cuando se corrige la hipoglucemia); 2 tipos de hipoglucemia => por causa del ayuno y postprandial (ver cuadro 11.4 libro).
- desencadenada por el ayuno: menos secreción de las glándulas productoras de hormonas hiperglucemiantes (la corteza suprarrenal y hipófisis anterior); insuficiencia hepática grave => no se produce glucogenólisis ni gluconeogénesis; exceso de alcohol => aumento NADH (inhibición de la gluconeogénesis); tumores pancreáticos => segregan insulina en exceso y desordenada; otro tumores de metabolismo hiperactivo => utiliza gran cantidad de glucosa;
- postprandial: perdida parte del estomago => absorción brusca de glucosa (hiperglucemia) seguida de secreción excesiva de insulina (hipoglucemia); idiopática.
HIPOGLUCEMIA
(b)- Hiperglucemia => elevación anormal de la glucemia que conduce a "diabetes" (> a 100 mg/dl en ayunas y > a 150 mg/dl en postprandial); causas:
- deficiencia absoluta de secreción de insulina o relativa como consecuencia del efecto de hormonas antagonistas;
- secreción excesiva de esteroides glucogénicos (glucocorticoides)
- secreción excesiva de ACTH (hormona adrenocorticotropa) como en síndrome de Cushing
- secreción excesiva de hormona del crecimiento
- secreción de catecolaminas
- hipertiroidismo y ayuno simple => la glucemia aumentan a niveles excesivamente elevados después de la administración oral de hidratos de carbono
Diabetes (diabetes mellitus) => una metabolopatía compleja, crónica que afecta al sistema vascular; causas:
- déficit de la insulina absoluto: la secreción de insulina es insuficiente para un funcionamiento normal del metabolismo de los hidratos de carbono
- relativo: la secreción es normal (o superior a lo normal), pero por estar aumentadas las necesidades, resulta insuficiente para cubrirlas;
Consecuencia directa de déficit de insulina => alteración en el metabolismo de los 3 principios inmediatos:
- metabolismo glucídico: hiperglucemia y glucosuria, debido a que => (1) se reduce el consumo de glucosa por parte del musculo y tejido adiposo, (2) disminuye la síntesis de glucógeno (3) se estimula la glucogenólisis y la gluconeogénesis;
- metabolismo lipídico: aumento de la lipólisis y se generan gran cantidad de AG /ácidos grasos => ácidos grasos en el higado se usan para síntesis de cuerpos cetónicos (cetogénesis) => pasan a la sangre y se acumulan (hipercetonemia) y se eliminan por la orina (cetonuria); el metabolismo de las lipoproteínas también se ve alterado.
- metabolismo proteico: aumento de la liberación de los aminoácidos a la sangre (proteólisis) por parte de las proteinas musculares (catabolismo proteico) => favorece gluconeogénesis en el higado.
Clasificación de la diabetes:
(a)- diabetes primaria o esencial => el déficit de insulina es idiopático o genético (defectos de los receptores de la insulina o reacciones autoinmunes); 2 tipos => ver cuadro 11.5 libro;
- tipo I (insulino dependiente o juvenil): edades tempranas < 30 años; consecuencia de la desaparición de células beta (productor de insulina); cursa con cetosis (aumento de cuerpos cetónicos en tejidos o fluidos orgánicos); peso corporal normal o inferior; frecuentemente se detectan Ac anti-islotes de Langerhans (autoinmune); presencia de ciertos Ags del sistema HLA;
- tipo II (no insulino dependiente): se manifiesta en la madurez > 40 años; disfunción de las células beta (responden de forma tardía y débil a la glucosa); resistencia a la acción de insulina debida a defectos del receptor; forma mas frecuente (90%) de los casos; es hereditaria; peso corporal supera lo normal;
- diabetes química o latente (tolerancia anormal/ patológica a la glucosa): los pacientes tienen una cifra < a la de los diabéticos; son personas con problemas de obesidad; se detecta una glucemia en ayunas < a 140 mg/dl y tras la prueba de tolerancia doral a la glucosa, a las 2 horas > o igual a 140 e inferior a 200 mg/dl, pero con algún otro valor superior a 200 mg/dl; prevención => reducción de la ingesta calórica y corregir el exceso de peso;
- diabetes gestacional /del embarazo: se reconoce por primera vez durante el embarazo; las que padecen => mayor riesgo y morbilidad y mortalidad perinatal, así como de padecer diabetes o intolerancia a la glucosa al cabo de unos años; se diagnostica mediante la prueba de la tolerancia oral de glucosa (PTOG)
(b)- diabetes secundaria o sintomática => el déficit de insulina esta originado por una enfermedad (eje. lesiones externas del páncreas, inflamaciones, hiperfunción de las glándulas secretoras de hormonas contra-insulares, fármacos, etc)
Diagnostico de la diabetes - las mas utilizadas se basan en la demostración de una tolerancia anormal a la glucosa; tolerancia disminuida => al padecer hiperglucemia y glucosuria en ayunas; VN 70-105 mg/dl en adultos y 80-115 mg/dl en mayores de 60 años; cabe posibilidad de realizar una prueba de tolerancia a la glucosa; para considerar una persona como diabética:
- aumento de glucemia > a 198 mg/dl y presencia de síntomas típicos (sed excesiva/polidipsia, emisiones excesiva de orina/poliuria, hambre excesiva/polifagia, disminución de peso corporal);
- una glucemia en ayunas > a 139 mg/dl, obtenida en 2 ocasiones
- una glucemia en ayunas menor de 140 mg/dl y 2 pruebas de PTOG con un nivel de glucosa a las 2 horas > a 198 mg/dl y al menos otro valor puntual también > a 198 mg/dl.
Las pruebas mas utilizadas para el diagnostico de la diabetes:
- las que determinan la glucosuria (supera el umbral renal 160 mg/dl)
- las que determinan la glucemia en ayunas, postprandial, prueba de sobrecarga de glucosa/PTOG (oral, intravenosa, sensibilizada con cortisol) ver cuadro 11.6 libro.
Pruebas de tolerancia oral de glucosa (PTOG)
- durante 3 días inmediatamente anteriores a la prueba, ingerir una dieta rica en carbohidratos
- se realiza por las mañanas (variación de la tolerancia mayor)
- administración de la glucosa 75 g en ayunas
- extracción cada 30 minutos durante 2 horas (venosa o capilar)
- a veces se tolera mal (vómitos => se debe anotar); la tolerancia a la glucosa disminuye con la edad;
Indicada para:
- pacientes con glucosuria, sin síntomas clínicos de diabetes y con glucemia normal tanto en ayunas y postprandial
- pacientes con síntomas de diabetes, sin glucosuria y con glucemia normales en ayunas;
- personas que tengan antecedentes familiares de diabetes mellitus
- mujeres que han dado a luz niños con peso excesivo (4-5 kg)
- embarazadas que presenten glucosuria
Interpretación de los resultados - en función de la glucemia frente al tiempo transcurrido, si la glucemia no desciende a las 2 horas => posibilidad de padecer diabetes; según la curva, el diagnostico puede ser => glucosuria renal, retraso del almacenamiento, diabetes leve o diabetes grave;
Esquema:
La diabetes gestacional o del embarazo - es una prueba para el diagnostico de la diabetes gestacional; se desencadena en el embarazo y desaparece después del parto; puede traer consecuencias graves para el feto si no es detectada a tiempo; las pruebas son:
(1) test O'Sullivan => *glucemia basal (en ayunas), *beber una solución de glucosa (50 g) y *glucemia después de 60 minutos; no es necesario realizar-lo a las gestantes < 25 años, peso corporal normal, no antecedentes familiares de diabetes, no pertenencia a grupo étnico con alta prevalencia de diabetes; en el resto de mujeres se indica a las 24-28 semanas de gestación (cuando tienen lugar los cambios hormonales que afectan a la producción de insulina) y a las 32-34 semanas, siempre que el test de diagnostico no sea positivo; un valor de glucemia superior o igual a 140 mg/dl es positivo => se hace curva de glucosa.
(2) curva de glucosa => se evalúa la capacidad de la paciente para tolerar una sobre carga oral de glucosa estándar (100 g) y se determina: *glucemia basal (en ayunas), *glucemia a los 30 minutos (después de la sobrecarga), 60 minutos, 120 minutos, 180 minutos; existe diabetes gestacional: 2 o mas resultados superan cifras => glucemia en ayunas 150 mg/dl, glucemia a la hora 190 mg/dl, a las 2 horas 165 mg/dl, a las 3 horas 145 mg/dl;
Cosas a tener en cuenta al realizar ambas pruebas => una ingesta alimentaria de carbohidratos 3 días antes de la prueba y estar en ayunas 12 horas antes del análisis, evitando fármacos que puedan interferir; desde la primera extracción (glucemia basal) hasta que finalice la prueba, no fumar, tomar café o te o comer nada, pero se debe beber abundante agua (ningún otro liquido); las manifestaciones como mareo, sudoración y debilidad son transitorias; no se debe caminar o realizar otro ejercicio físico.
Determinación para valorar el funcionamiento del metabolismo de los hidratos de carbono - los mas importante son (ver cuadro 11.7 libro):
- determinaciones de la glucemia basal (mira mas abajo!!)
- determinaciones de la glucosuria;
- determinación de cuerpos cetónicos en sangre (cetonemia) y en orina (cetonuria);
- prueba de la sobrecarga oral de glucosa
- det. de hormonas (insulina, glucagón, glucocorticoides, GH, adrenalina), sobre todo la insulinemia;
- determinación de enzimas sustratos hidrocarbonados en células y tejidos (hemoglobina glicosilada)
- micro-albuminuria
- determinaciones inmunológicas
- determinación de receptores
Determinación de la glucemia basal por métodos enzimáticos:
Glucosa-oxidasa => es una enzima que cataliza la reacción de la glucosa presente en la muestra; el método mas usado para cuantificar los resultados es la determinación del peróxido de hidrógeno /Trinder; es un método colorimétrico e enzimático para determinación "in vitro" de la concentración de glucosa en suero o plasma; el color sera proporcional a la concentración de glucosa; la técnica se basa en la oxidación de la glucosa presente en la muestra catalizada por la GOD (glucosa oxidasas) => se forma peróxido de hidrógeno que reacciona con un compuesto coloreado (Ac glucónico) => se forma producto coloreado que es proporcional a la concentración de glucosa y se mide con espectrofotometría; fundamento de la determinación => (1) Glucosa + H2O + O2 + GOD/glucosa oxidasa => acido glucónico + H2O2 (peróxido de hidrógeno); (2) H2O2 + cromógeno => compuesto coloreado; si la lectura se realiza con el espectrofotómetro manual, habrá que hacer los cálculos oportunos para pasar la absorbancia (DO) obtenida a concentración de glucosa, basándose en la concentración del estándar; con el espectrofotómetro semiautomático y el autoanalizador la concentración nos sera dada directamente.
Hexoquinasa => enzima puede fosforilar a cualquier hexosa (un monosacárido -azúcar- como la glucosa o fructosa), por tanto, es una enzima de baja especificidad (fosforilación); proporciona el grado máximo de especificidad a la hora determinar la glucosa presente en la muestra (método de referencia); primer paso: Glucosa + ATP + hexoquinasa => glucosa-6-fosfato + ADP; segundo paso: Glucosa-6-fosfato + NADP => NADPH (se mide en el espectrofotómetro a 340 nm); el resultado es directamente proporcional a la concentración de glucosa.
Determinaciones del metabolismo de los hidratos de carbono:
Glucosa en orina => valores normales de glucosuria es negativa; solo se detecta cuando se supera el umbral renal (glucemia > 160-180 mg/dl).
Cuerpos cetónicos => la determinación se lleva a cabo en sangre y orina; los cuerpos cetónicos son derivados de los ácidos grasos y la variación de sus niveles en sangre (cetonemia) y orina (cetonuria) informa indirectamente acerca del metabolismo hidrocarbonado.
Sobrecarga oral de glucosa => permite distinguir entre diversas alteraciones del metabolismo hidrocarbonado: (a) cuando uno de los valores > 200 mg/dl y el obtenido a las 2 horas esta entre 140-200 mg/dl => intolerancia a la glucosa (b) cuando en 2 momentos de la prueba (1 de ellos debe ser el obtenido a las 2 horas) la glucemia es > a 200 mg/dl => diabetes.
Hormonas insulina => se determina insulinemia y las hormonas contra-insulares (glucagón); en ocasiones, se determina el péptido C mediante RIA o ELISA (para averiguar si es hiper-insulinemia endógeno o exógeno => insulina de preparados comerciales no llevan péptido C).
Hemoglobina glicosilada => es una fracción de la hemoglobina A, unida de forma irreversible (mediante enlaces covalentes) a glucosa; su aparición es proporcional a los niveles de glucosa en sangre; no es util para el diagnostico de la diabetes; es una técnica muy especifica, pero su sensibilidad es escasa (la obtención de Hb glicosilada anormal, no excluye una diabetes); métodos mas utilizados: HPLC => cromatografia de intercambio iónico, cromatografia de afinidad, etc; inmunológicos => la lectura se realiza por turbidimetría.
Microalbuminuria => excreción de pequeñas cantidades de proteínas en orina que no pueden ser detectadas por los métodos habituales de determinación de proteínas en orina (tiras reactivas); sirven para controlar diabetes; una detección precoz puede evitar complicación; método => inmunoquímicos (buena sensibilidad y especificidad y es automatizables); la cuantificación se realiza mediante turbidimetría o nefelometría.
Determinaciones inmunológicas => se utilizan para determinar la presencia de Acs específicos contra la insulina o contra las células pancreáticas beta; métodos => enzimoinmunoanalisis (ELISA) y la inmunofluorescencia indirecta (FIA).
Determinación de receptores => la cantidad de receptores para la insulina determina en muchos casos la afectividad de su acción como hormona hipoglucemiante.
Tema 15 - Enzimología Diagnóstica
Enzimas (biocatalizadores) - proteínas biologicas especializadas en la catálisis (acelera catabolismo) de reacciones orgánicas; composición: las holoenzimas pueden contener fracción proteica (apoenzima) y no proteica /peso molecular menor (cofactores) que a su vez puede ser => (1) iones metálicos (activadores enzimáticos => ayudan a captar el sustrato para conseguir el producto; no se modifican durante la catálisis) o (2) moleculas orgánicas (grupos prostéticos - se unen permanentemente; coenzimas - se unen solo durante la reacción);
Mecanismo de acción enzimatica - la función de biocatalizadores orgánicos (enzimas) es acelerar la velocidad de las reacciones al disminuir la energía de activación y la obtención mas rápida de los productos.
Reacción enzimatica: enzima + sustrato = enzima-sustrato = enzima-producto = enzima + producto
- reacción sin catalizar (gasta mas energía): estado inicial A+B + energía de activación => estado de transición estable => estado final C+D
- reacción catalizada (gasta menor energía): estado inicial A+B + energía de activación => estado de transición altamente energético e inestable => estado final C+D
Formas en las que pueden aparecer las enzimas:- isoenzimas (isozimas) => formas múltiples de una determinada enzima y catalizan la misma reacción; tienen pequeñas diferencias en cuanto a sus propiedades físico-químicas, tamaño, estructura, PM, solubilidad, comportamiento catalítico, etc.; LDH (lactato deshidrogenasa) aparece en 5 formas isoenzimáticas que catalizan la reacción reversible => LD-5:M4 (músculos/ higado), LD-4:M3H, LD-3:M2H2, LD-2:MH3, LD-1:H4 (corazón); CK (creatín quinasa/cinasa) tiene 3 formas isoenzimáticas => CK-BB (cerebro), CK-MB (miocardio), CK-MM (musculo esquelético);
- complejos multienzimáticos => son asociaciones de enzimas que catalizan reacciones consecutivas;
- proenzimas => precursores inactivas de las enzimas proteolíticas que catalizan la hidrólisis de enlaces peptídicos; el paso de pro-enzima a enzima supone la ruptura de un enlace peptídico.
Fenómenos catalitico:(1) Interacción enzima-sustrato (E-S) => tiene lugar en centro activo en forma de puentes de hidrógeno, interacciones electrostáticas, fuerzas de Van der Waals y covalente.
(2) Conformación del centro activo (CA) => hipótesis de llave-cerradura (rígida/estructura complementaria); hipótesis del acoplamiento inducido (no rígida/ el sustrato induce un cambio en la estructura de la enzima para acoplarse).
(3) Especificad enzimática => absoluto (solo con un sustrato); de reacción (actúa con diferentes sustratos de característica común); estéreo-específica (actúa sobre sustrato con determinada configuración espacial)
(4) Factores que influyen en la actividad enzimática:
- concentración de sustrato: cuanto mas sustrato, mas velocidad => proporcional hasta un punto máximo / constante de Michaelis Menten/ km; gráficamente se observa => cinética de primer orden: cuando la velocidad directamente proporcional a la concentración de sustrato y cinética de orden cero: cuando se alcanza la velocidad máxima ya no depende de la concentración de sustrato - la velocidad no aumenta (la enzima esta saturada); en las determinaciones analíticas de la AE (actividad enzimática) => se trabaja en la zona cinética de orden cero, por eso, los reactivos comerciales se preparan con exceso de sustrato;
- pH: se trabaja en las condiciones optimas de pH (se emplea disolución tampón que lo mantiene); variaciones de pH pueden alterar la estructura proteica;
- temperatura: a mas temperatura mas AE, siempre que no se supere el punto que la estructura proteica se desnaturalice, se elimine o disminuya esta actividad (37ºC);
- presencia de inhibidores /activadores: son sustancias que inhiben o aumentan la velocidad de la reacción; los activadores suelen ser iones metálicos o moleculas de pequeño tamaño.
(5) nomenclatura (clasificación de enzimas)
- óxido-reductasas => catalizan reacciones de oxidación-reducción (deshidrogenasas, oxidasas, reductasas); A + B => A reducido + B oxidado
- transferasas => catalizan reacciones de transferencia de grupos funcionales, partes de moleculas, de un donador a un aceptor (transaminasas); A-B + C => A + B-C
- hidrolasas => catalizan reacciones de hidrólisis de enlaces al añadir una molécula de agua (lipasas, amilasa, peptidasas); A-B + H2O => A-H + B-OH
- liasas => catalizan reacciones de eliminación o adición de alguna molécula, grupo funcional etc (descarboxilasa); A-Co2 => A + CO2
- isomerasas => catalizan reacciones de isomerización (epimerasas, mutarotasas); A => A*
- ligasas => catalizan reacciones de condensación de 2 moleculas por formación de un enlace a costa de la hidrólisis de un trifosfato (sintetasas); A+B + NTP (ATP) => A-B + NDP (ADP) + Pi (fosfato)
Enzimas analizadas en diagnóstico clínico:
1- Transaminasa glutámico oxalacética (GOT) o aspartato aminotransferasa (AST) - transaminasas - se localiza en mitocondrias y citoplasma de tejido cardíaco, hepático, muscular, hematíes, tejido esquelético, renal y uretral => marcador sérico en patologías hepatopatias, miopías, procesos cardíacos.
2- Transaminasa glutámico pirúvica (GPT) o alanino aminotransferasa (ALT) - transaminasas - se encuentra en citoplasma del tejido hepático, muscular, renal y cardíaco => marcador sérico en patologías hepatopatias, miopatías.
3- Lactato deshidrogenasa (LDH) - óxido-reductasas - se localiza en los tejidos cardíaco, muscular, renal hepático cerebral y hematíes => es un marcador sérico en patologías hepatopatías, procesos cardíacos y miopatías.
4- Creatín fosfoquinasa (CPK) - transferasas - se encuentra en musculo esquelético, cardíaco y cerebro => es un marcador sérico en patología miopatias, procesos cardíacos.
5- gamma-Glutamiltranspeptidasa (GGT) - transferasas - se localiza en citoplasma de celulas hepáticas, riñón, intestino y páncreas => marcador sérico en patologías hepatopatías, pancreáticas.
6- alfa-amilasa - hidrolasas - se encuentra en glándulas salivares y páncreas exocrino => enfermedades del páncreas
7- lipasa - hidrolasas - su localización es pancreática => enfermedades del páncreas
8- fosfatasa alcalina (ALP) - hidrolasa - se localiza en hueso, hígado, riñón, intestino, glándula mamaria y placenta => marcador sérico en enfermedades oseas (actividad osteoblástica), hepatopatías/ colestática (con elevación de transaminasas); se distinguen ambas mirando sus isoenzimas;
9- fosfatasa ácida - hidrolasa - se encuentra en la próstata, el higado, hematíes, plaquetas y hueso => es un marcador sérico en carcinoma prostático (sintetiza psa/antígeno prostático especifico glucoproteína - como marcador de próstata).
I. La principal isoenzima que se determina por estar localizada en células cardiacas es CK-MB
(1) la CK-MB (creatín fosfoquinasa-miocardio, mas especifica de lesión muscular cardíaca); en el IAM pueden pasar hasta 3-6 horas antes de que se detecta una elevación de la CM-MB, luego aumentan rápidamente (hasta 10-20% de la CK total - su VN 3-6%) alcanzando su máximo a las 24 horas y luego desciende rápidamente en 1-4 días;
(2) LDH1y2 (lactato deshidrogenasa-heart) => su incremento es mas lento que CK - a las 12 horas y alcanzan su máximo a las 36-72 horas y su normalización en 1-2 semanas; VN = 120-240 U/L (25ºC)
(3) GOT o AST (glutámico oxalacética o aspartato aminotransferasa) => no es especifica del IAM, pero una concentración normal de GPT y aumentada del GOT, nos puede relacionar con IAM; su elevación ocurre a las 6-8 horas con punto máximo a las 18-24 horas y puede persistir hasta 5 días después del IAM (nos puede ayudar a saber cuando ocurrió el IAM), según sea mayor o menor su aumento nos orientara en el mejor o peor pronostico; su VN 5-35 UI/L
II. Marcadores cardiopatía precoces, aparecen a las pocas horas: MIOGLOBINA (proteína cardiaca) => es mas especifica que las enzimas para valorar el daño miocardio; se eleva rápidamente (entre 3-6 y de forma breve en sangre por lo que es muy buen marcador para diagnosticar IAM entre las 3-6 horas después de los síntomas; TROPONINA (subunidades I y T - cardíacas) => son muy sensibles y especificas en el diagnósticos del IAM cuando su concentración aumenta en el plasma; son liberadas por las células lesionadasentre 3-12 horas después del IAM y permanecen elevadas bastante mas tiempo que CK-MB; permiten diferenciar en daño miocárdico reversible del irreversible, diagnostico de infartos en procesos quirúrgicos cadenas ligeras y pesadas de miosina => permanece hasta 15 días (la I); la acción combinada de troponina T y CK-MB permite confirmar o no un IAM en las primeras 3-6 horas; la troponina I permite un diagnostico temprano del IAM (a las 4 horas de los síntomas).
III. Electrocardiograma - aunque el patrón del IAM puede no aparecer hasta 24 horas después del infarto; varían según el tamaño y lugar de la lesión.
Determinación analitica de la actividad enzimática - no se mide la cantidad de enzimas en el suero, porque su concentración es baja; sin embargo dada su elevada capacidad catalítica, es posible determinar su actividad con fiabilidad y se presupone que por lo general la actividad es proporcional a la concentración;
a- Es necesario conocer:- la estequiometría de la reacción que cataliza
- si necesita o no cofactor y cual es
- la concentración minima de sustrato y cofactor para alcanzar la máxima velocidad de reacción
- las condiciones optimas de medida => pH, tiempo de incubación, procesado de la muestra biológica y los reactivos (se debe procesar de inmediato para evitar la hemólisis - si la muestra esta hemolizada, se recomienda una nueva extracción porque los hematíes tienen muchas enzimas e interfieren; los fármacos tambien pueden alterar la concentración de enzimas), temperatura, posibles activadores e inhibidores endogénos y exógenos de la muestra;
- las características de la técnica analitica para esa muestra biológicab- Debidos a la presencia de la enzima en la muestra y a su actividad especifica, se puede determinar la actividad enzimática (AE) analizando como parámetro:
- la aparición de algún producto- la desaparición del sustrato
- la variación del cofactor o de algún componente de la reacción en el transcurso de la misma
c- Técnica analitica mas empleada => espectrofotometría ultravioleta-visible (UV-V)
d- Fase de retardo - se debe medir la absorbancia en esta fase; el tiempo de retardo esta indicado por los protocolos comerciales.
e- Fase lineal => se determina la actividad enzimática, porque la velocidad de formación del producto es constante.
f- La velocidad comienza a disminuir debido a => agotamiento de sustrato, variaciones de pH que no han podido ser amortiguadas por el tampón, efectos de inhibición de la enzima, etc.
g- AE se mide en UI-ml => unidad internacional como la cantidad de enzima que transforma un micromol de sustrato en un minuto en condiciones estándar previamente establecidas (en cada unidad se define la unidad de actividad y sus unidades.
Metodos analíticos de determinación de actividad enzimática - no es importante un dato puntual de absorbancia sino la variación de la absorbancia por unidad de tiempo ocasionada por la AE.
(1) Metodos a punto final => no es frecuente; se supone que la reacción es lineal y la cinética de orden cero no ocurre siempre; pasos: se ponen en contacto los reactivos (que aportan el sustrato) y la muestra biológica (aporta la enzima) y tras un periodo de incubación que supere el periodo de retardo, se mide la absorbancia; al cabo de un tiempo establecido se detiene la reacción y se vuelve a medir la absorbancia;
(2) Metodos cinéticos => medir la absorbancia varias veces con intervalo de minutos; permite comprobar que realmente estas en la zona lineal de la curva, zona ideal para la determinación; si se detectan desvíos de la linealidad, se puede despreciar alguna de las medidas finales de la absorbancia; en los protocolos comerciales se indican los pasos a seguir en cada determinación para que el resultado sea fiable; tipos =>
a. En muchas reacciones enzimáticas participan como cofactores los complejos NAD-NADH o NADP-NADPH y en esta participación se basan muchos metodos analíticos.
b. Metodos colorimétricos miden la formación del color.
Calculo de la actividad enzimática - una vez obtenida la variación de absorbancia por minuto, para calcular AE se pueden emplear los siguientes metodos:
- la aplicación de una variante de la ley de Lambert-Beer
- la construcción de una recta de calibrado
- medidas indirectas de la concentración de sustrato
Formula => AE (UI-L) = DO/min x factor de calculo
Tema 16 - Función Hepática
Higado - un órgano de naturaleza glandular, profusamente vascularizado, rodeado por una capsula fibrosa con un peso +/- 2,5% del peso corporal; es el encargado de la transformación bioquímica delos principios inmediatos ingeridos en la diete y absorbidos a nivel intestinal, así como su distribución por todo el organismo; irrigado por la arteria hepática y la vena porta, la sangre sale del higado por venas supra-hepáticas que desembocan en la vena cava inferior; histología => células hepaticas o hepatocitos, elementos vasculares (vasos sanguíneos, vasos linfáticos y vías biliares), parénquima (la propia masa glandular);
Función:
- Interviene activamente en el metabolismo de los principios inmediatos
- Participa junto con la médula osea y el bazo en los procesos de síntesis y regeneración sanguinea
- Forma la bilis (cuya composición: sales biliares, bilirrubina, urobilinógeno, colesterol, agua fosfolipidos, electrolitos)
- Encargado de la eliminación de productos potencialmente tóxicos para el organismo (detoxificación por bio-transformación)
- Participa en las funciones del sistema monocito-macrófago (SRE)
- Participa en el metabolismo de hormonas y vitaminas =>
(1) sintetiza proteínas encargadas de transportar hormonas y vitaminas en la sangre
(2) degrada las hormonas y facilita su eliminación
(3) sirve de almacén de ciertas vitaminas
(4) participa en el metabolismo de la vitamina D3 activa (calcitriol)
Actuación hepática en el metabolismo de los principios inmediatos - se encarga de proporcionar a los tejidos: energía, glucosa y ácidos graso en periodos inter-digestivos.
a. Hidratos de carbono:- después de las comidas => almacena la glucosa en forma de glucógeno o TG
- entre las comidas => glucogenogénesis y gluconeogénesis
b. Lípidos:
- moviliza ácidos grasos procedentes del tejido adiposo (lipólisis)
- sintetiza AG a partir del exceso de glucosa y AA => para sintetizar TG que forma parte de las lipoproteínas VLDL y HDL
- utiliza AG para sintetizar "cuerpos cetónicos" (fuente de energía para higado y el resto del organismo)
- sintetiza colesterol (1,5-2 g diarios)
c. Proteínas:
- metaboliza selectivamente los AA
- utiliza el amoniaco de la degradación AA, del riñón y intestino, para síntesis de urea y glutamina
- sintetiza proteínas plasmaticas (albumina, factores de coagulacion, etc.)
Actuación hepática en la secreción biliar - formar la bilis, cuya composición: sales biliares, bilirrubina, urobilinógeno, colesterol, agua fosfolipidos y electrolitos que desempeña funciones de:
- Servir de vehículo para la eliminación de bilirrubina, colesterol y otras sustancias
- Mantener disuelto el colesterol
- Facilitar la digestión y absorción de las grasas a nivel intestinal (mediante las sales biliares)
Metabolismo de la bilirrubina:
- una pequeña parte de BB tiene su origen en el catabolismo de enzimas hepáticas (citocromos, catalasas) y en la destrucción en la MO de eritrocitos (inmaduros)
- la mayor parte de BB procede del catabolismo de la Hb presente en el interior de los eritrocitos que tiene lugar en las células del SRE (bazo, higado, ganglios linfáticos y MO); los hematíes que ja han completado su ciclo vital (120 días) son degradados, liberando la Hb que contenían; Hb se desdobla en globina y grupo HEM ; grupo HEM se desdobla, liberando el átomo de Fe y el HEM se transforma en una cadena lineal formado por 4 anillos (pirrólicos) que son la estructura básica de los pigmentos biliares; el 1er pigmento formado es biliverdina; tras su reducción => bilirrubina indirecta (insoluble e hidrofóbica); este se incorpora a la sangre unida a la albumina; en el hepatocito se conjuga con el ácido glucurónico => BB hidrosoluble/conjugada y directa; una pequeña parte regresa a la sangre, pero la mayor parte accede al intestino delgado por el esfínter de Oddi; por la acción de la flora intestinal, una parte se transforma en estercobilinógeno que al oxidarse => estercobilina, se elimina por las heces (confiere su color característico); el resto de BB conjugada se absorbe en el intestino y pasa a la sangre y se elimina por la orina (una pequeña parte) y la mayor parte vuelve al higado e intestino (circulación entero-hepática).
Función de la bilis => servir de vehículo para la eliminación de colesterol, bilirrubina y otras sustancias; mantener disuelto (emulsionado) el colesterol; favorecer la digestión y absorción de las grasas a nivel del intestino delgado (debida a las sales biliares)
Actuación hepática en la destoxificación por bio-transformación - toxico endogénos (bilirrubina, amoniaco) y exógenos (tóxicos, fármacos):
- Modificar su actividad reduciendo o eliminando su toxicidad orgánica- Hacerlos hidro-solubles y por tanto fácilmente eliminables (vía biliar o urinaria)
Actuación hepatica a nivel del sistema monocito-macrófago (célula Kupffer/fagocitosis) - sistema retículo endotelial que atribuyen a las siguientes funciones:
- hematopoyesis- respuesta inmunitaria (especifica y inespecifica)
- funciones de tipo metabólico
- formación de pigmentos
Actuación hepática en el metabolismo de hormonas y vitaminas:
- Sintetiza proteínas transportadoras de hormonas y vitaminas en el torrente sanguíneo
- Degradar las hormonas y facilitar su eliminación
- Almacena vitamina D (circulación entero-hepática)
Trastornos hepáticos - clasificación morfologica de las hepatopatías
A. Enfermedades del parénquima (alteraciones intra-hepáticas)
- Hepatitis (viral o toxico - aguda o crónica)
- Cirrosis (de origen alcohólico; de tipo biliar; hemocromatosis => acumulación de Fe, cirrosis, intolerancia de hidratos de carbono; posnecrótica; fibrosis quística pancreatica /enfermedad de Wilson)
- Infiltrados (de grasa TG, colesterol; de glucógeno; de tipo amiloide; otros (leucemia, linfoma, granuloma)
- Lesiones que ocupan un espacio (tumores, quistes, abscesos)
- Trastornos funcionales que cursan con ictericia => supresión o detención del flujo de bilis (colestasis) en el embarazo; diversos síndromes.
B. Enfermedades hepato-biliares (resultado de alteraciones en las vías biliares donde fluye la bilis)- Obstrucción biliar extra-hepática
- Colangitis (inflamación de los conductos biliares)
C. Enfermedades vasculares (son de origen circulatorio)
- Malformaciones arteriovenosas
- Trombosis de la vena hepática o de la vena porta
- Congestión pasiva crónica
Trastornos mas frecuentes de la funcionalidad hepática:
Trastornos en el metabolismo de los principios inmediatos
(1) Hidratos de carbono
- hiperglucemia => siempre que los niveles de insulina no < de VN, puede ser debida a una reducción de la capacidad del higado para metabolizar la glucosa/ glucogenogénesis y gluconeogénesis (disminución del numero de hepatocitos y alteraciones de la estructura hepática);
- hipoglucemia => solo en insuficiencias hepáticas graves como consecuencia de la incapacidad del higado para sintetizar y liberar glucosa (glucogenólisis) al torrente sanguíneo.
(2) Lípidos - déficit de ciertas enzimas que intervienen decisivamente el metabolismo lipídico causando alteración en la vía metabólica; déficit de lecitil-colesterol-acil-transferasa (LCAT) que regula la esterificación del colesterol en sangre => aumenta el colesterol libre que se deposita sobre la membrana de hematíes (se altera), los hace mas frágiles y causa anemia hemolítica.
(3) Proteínas
a- La urea NH2CONH2 se sintetiza en el higado de la neutralización del anión bicarbonato HCO3- con amonio NH4; una deficiencia hepática puede provoca:
- acumulo de amonio en sangre => alteración cerebrales graves (encefalopatía hepática)
- nivel alto de bicarbonato en sangre => alcalosis (pH alcalina de la sangre)
- descenso en la síntesis de urea y su nivel en el plasma
b- Fallo a nivel hepático de la síntesis de factores de la coagulacion (de carácter proteico)
Trastorno en la función biliar
(1) Ictericia - coloración amarilla que aparece en la piel y mucosas debida a la presencia de un pigmento, la bilirrubina, cuando este se encuentra en la sangre > 2 mg/dl; indica trastornos en la formación, captación conjugación y eliminación (el proceso mas difícil) de la bilirrubina por el higado.
Causas - clasificación fisiopatológica:
- Aumento de la producción de BB en anemias hemolíticas => incapaz de asumir el aumento de BB debido a la rotura masiva de eritrocitos => acumulación de BB indirecta.
- Captación anormal de BB por los hepatocitos en síndrome de Gilbert => falla la síntesis hepatica de la proteína transportadora (albumina) => acumulación de BB no conjugada.
- Alteración del proceso de conjugación de BB en trastorno del recién nacido => inmadurez de la glucoroniltransferasa => acumulación de BB insoluble.
- Trastorno en la eliminación de la BB conjugada en hepatopatías difusas, enfermedades congénitas => incapacidad de los hepatocitos para eliminar la BB conjugada con la bilis => acumulación de BB conjugada.
- Alteraciones del flujo biliar de la BB en diversos trastornos de obstrucción en las vías biliares => la BB conjugada al no poder seguir su camino normal, vuelve a la sangre => acumulación de BB directa.
Tipos de Ictericia:
- Pre-hepática o hemolítica => aumenta la BB indirecta en el suero- Hepática o hepato-celular => aumenta la BB directa y indirecta
- Post-hepática u obstructiva => aumenta la BB directa
Diagnostico - para determinar que tipo de ictericia instaurado es necesario los datos de:
- tipo de BB preferentemente aumentada en el suero
- presencia o ausencia de BB en orina (coluria)
- color de las heces y cantidad de urobilinógeno en ellas
- cantidad de urobilinógeno en la orina
(2) Colestasis - la alteración de la formación de la bilis o de su excreción hacia el duodeno por causa de un mal funcionamiento de las células hepáticas (hepatocitos)/ intra-hepático o por obstrucción de las vías biliares/ extra-hepático; inicialmente => ictericia, coluria, hipocolia o acolia (disminución de secreción biliar) y prurito; posteriormente => si se prolonga aparecen xantomas (alteración cutanea de un trastorno del metabolismo lipídico) esteatorrea (exceso de grasa en las heces/heces blancas) y síndrome de malabsorción; diagnostico => ecografía, tomografía axial computerizada (TAC) y datos laboratorio.
Clasificación de colestasis (segun sus causas):
Intrahepática => infecciones (hepatitis vírica), tóxicos (alcohol, fármacos, de origen industrial), neoplasias (carcinoma, metástasis), infiltraciones (amiloidosis), otras (cirrosis hepática, embarazo, postoperatorio).
Extrahepática => litiasis (en el colédoco), neoplasias (pancreática, en la vesícula biliar, en las vías biliares), infestaciones parasitarias (hidatidosis, ascáridos, fasciola hepática), pancreatitis (aguda o crónica) otras causas (estenosis del conducto biliar, ulcera duodenal).
Trastornos en la capacidad de detoxificación por bio-transformación - como consecuencia de la insuficiencia hepática para eliminar ciertos compuestos, puede aparecer una cierta intolerancia a sustancias => fármacos, tóxicos, etc. que no pueden ser degradadas y se acumulan, llegan a provocar trastornos.
Trastornos en el metabolismo de hormonas y vitaminas - puede causar importantes alteraciones (cualitativa y cuantitativas) de la síntesis de algunos metabolitos como "somatomedina" (hormona imprescindible para un funcionamiento normal de la hormona del crecimiento (GH)
Determinación de la funcionalidad hepática:
- de tipo físico (palpación y percusión del abdomen) => la sensibilidad, consistencia y textura de la superficie hepática; el aumento del tamaño del higado (hepatomegalia => tumores, insuficiencia cardiaca, obstrucción de las vías biliares y inflamación en hepatitis);
- de tipo instrumental
- de tipo funcional
Técnicas de exploración instrumental de las hepatopatías
- Radiologia: en caso de hepatomegalia => el diafragma derecho es desplazado hacia arriba (Rx torax)
- Gamma-grafía: mediante isotopo radioactivo con afinidad sobre los hepatocitos y células Kupffer => ofrece imagen de la existencia de lesiones (abscesos, quistes y tumores) que no tienen capacidad de fijar el compuesto radiactivo.
- TAC: ofrece imagen del higado con su forma y tamaño, la existencia de lesiones, calibre de las vías biliares.
- Ecografía: utiliza ondas sonoras que da información => tipo lesiones existente, si es solida o líquidos, calibre de los conductos biliares intra-hepáticos
- Laparoscopia: introducción de un dispositivo óptico en la cavidad abdominal => permite observar directamente el higado.
- Punción-biopsia: la obtención de una muestra del tejido hepático para su posterior estudio mediante anatomía patologica.
Pruebas funcionales hepáticas
Marcadores séricos de las hepatopatías - son constituyentes sanguíneos, útiles en el reconocimiento de la enfermedad hepática, aunque no sirven para medir la funcionalidad hepática global; su alteración refleja fundamentalmente el daño del hepatocito o del árbol biliar; citolisis hepática/ necrosis hepato-celular/ rotura celular => las enzimas saldrán al exterior aumentando su nivel en el suero; disminución de sus niveles séricos => inhibición de la síntesis de enzimas; perfil hepático de rutina => GOT, GPT, ALP, GGT, Bilirrubina
Transaminasas (GOT y GPT) - el aumento de ambas nos indica citolisis hepática; la GPT aumenta en lesiones de poca entidad y la GOT aumenta en lesiones hepáticas mas graves; tienen poco valor pronostico, pero se usan para determinar la actividad de las enfermedades hepáticas con lisis celular.
- Glutamicoxalacetica (GOT) o Aspartatoaminotransferasa (AST): se encuentran en el interior de células hepaticas y musculares (tanto en el citoplasma como en las mitocondrias); VN plasmáticos = 5-35 U/L; se encuentra aumentada en lesiones hepáticas graves (> de 3000 U en hepatitis agudas y mas moderado en hepatitis crónicas), en necrosis del miocardio (IAM), en procesos que afectan las células musculares (triquinosis => parásitos de cerdo/jabalí), necrosis tisular (embolia pulmonar) y hemólisis masivas con ictericia; disminución: difícil (sera por desaparición absoluta del parénquima hepatica).
- Glutamino piruvica (GPT) o Alaninaminotransferasa (ALT): se encuentra solo en el citoplasma de las células sobre todo hepáticas (hepatocitos) y musculares; VN plasmáticos < 55 U/L; esta aumentada en los mismos casos que la GOT, pero sugiere mas a una alteración hepática, en hepato-carcinoma, en metástasis hepáticas y hepatitis; cualquier aumento indica enfermedad que afecte al higado (es mas especifica del hígado);
- Fosfatasas alcalina (ALP): son un conjunto de isoenzimas (se difieren en sus propiedades físicas, químicas e inmunológicas) y se encuentra aumentada fundamentalmente en las alteraciones oseas (osteoporosis) y hepáticas; VN = 60 - 250 U/L; la isoenzima hepática aumenta cuando existe obstrucción biliar total o parcial (colestasis) o una lesión que ocupa un espacio en el higado (tumor o quiste); la elevación de las fosfatasas alcalina hepática es indicativa de: colestasis (patrón de colestasis => el aumento de ALP hepática y GGT, mientras los niveles de las transaminasas son normales), cirrosis hepática y metástasis hepáticas, carcinomas de vesícula biliar, etc; se encuentra disminuida en personas que sufren hipotiroidismo y niños que presentan retraso en el crecimiento; pruebas que acompañan a F.A./ALP =>
- LAP y 5-NT - son enzimas de gran utilidad para aumentar la especificidad de la FA, ya que se encuentran elevadas en las enfermedades hepáticas, pero no en los trastornos óseos; FA/ALP + LAP o 5-NT elevados => alteración hepática; si LAP y 5-NT son normales => otro origen.
Alteración de la fosfatasa alcalina / ALP (esquema)
- gamma-Glutamiltranspeptidasa (GGT) - es un marcador de gran sensibilidad para hepatopatías (citolisis y colestasis); VN = 5-40 U/L; cuando su valor plasmático es normal, es muy posible que no haya ninguna alteración a nivel hepático; se utiliza en combinación de la ALP para diferenciar el origen hepático u oseo de una alteración; ALP + GGT elevadas y GOT + GPT normales => colestasis; todas elevadas => citolisis.
- Lactato deshidrogenasa (LDH) - presente en la mayor parte de las células del organismo, formada por varias isoenzimas; LDH-5 es de localización hepática; su aumento es indicativo de necrosis hepato-celular o de carcinoma metastásico de hígado; VN = 230-480 U/L.
- Bilirrubina (BB) => hiper-bilirrubinemia fisiológica (recién nacido, permanecer en grandes alturas) cursa con ictericia; hiper-BB patológica (pre-hepática/hemolítica, hepática/hepato-celular, post-hepática/obstructiva); hipo-bilirrubinemia aparece en anemias intensas (ferropénicas, aplásicas); VN de BB total 0,15 - 1 mg/dl mas de 2 mg/dl => ictericia; VN de BB directa/conjugada 0-0,25 mg/dl; VN de BB indirecta/insoluble 0,15-0,8 mg/dl; el aumento de BB directa/conjugada => alteraciones en el flujo biliar/ colestasis; el aumento de BB indirecta/unida a la albumina es causado por => anemias hemolíticas masivas, fallo de la proteína transportadora, alteración del proceso de conjugación fisiológica => la inmadurez de la glucuroniltransferasa; para ver que tipo de ictericia => que tipo de BB aumenta, coluria en la orina, presencia o ausencia de BB en las heces;
El diagnostico de las enfermedades hepáticas en el laboratorio, todavía no es totalmente satisfactorio. Ocasionalmente siguen apareciendo hepatopatías crónicas en las que todas las pruebas BQ arrojan resultados normales. En casos excepcionales se puede demostrar una relación causa-efecto entre determinadas pruebas y la etiología o alteración detectada a nivel hepático. La prueba funcional, la causa de la alteración hepática y la patología, no se encuentran en estricta correlación, por esto hay que acompañan las con pruebas de TAC, ecografía, etc.
Parámetros biológicos para Hepatitis
(1) Transaminasas => en las hepatitis sus niveles plasmáticos son entre 10 y 100 veces superiores a VN
(2) Pruebas de Coagulacion => la mas utilizada es Tiempo de Quick (se reduce mas de la mitad - proceder a la hospitalización)
(3) Serología => investigación de la presencia de ciertos Ags procedentes del virus causante de la hepatitis; determinación de los distintos Acs específicos (IgM e IgG) que aparecen en el plasma de la persona afectada, tanto cualitativa como cuantitativamente.
(4) Proteinograma
Tema 17 - Función Endocrina
Hormona - es un mediador/mensajero químico que es secretadas por glandulas especializadas y influye en la actividad de las células (regulador bioquimico); funciones => mantener la homeostasia; iniciar, mediar y regular los procesos de crecimiento, desarrollo, maduración, reproducción y envejecimiento; endocrinología => estudia la comunicación y el control ejercidos dentro de los organismos vivos por medio de mensajeros químicos/hormonas; el sistema endocrino junto con el sistema nervioso conforman el mecanismo por el cual el organismo controla e integra la función de los distintos tejidos y órganos, sintetizando y liberando hormonas;
Clasificación - pueden agruparse en cuatro grandes familias en función de su estructura química:
- Péptidos; de diferente complejidad: TSH (h.tiroestimulante/tiroliberina), GH (h.del crecimiento), polipéptidos (glucagón), oligopéptidos (vasopresina), glucoproteína (gonadotropinas)
- Derivadas de aminoacidos: triyodotironina, adrenalina- Esteroideas (derivan del colesterol): progesterona, andrógenos, estrógenos, corticosteroides, vit. D
- Derivadas de los ácidos grasos: prostaglandinas
Los mecanismos de acción de las hormonas (las funciones):
- función Autocrina y paracrina (ella misma y celula vecina): retrogadamente sobre sus células de origen para modular su propia secrecion u otros procesos intracelulares; la células secretora es a la vez diana;
- función Paracrina: actua sobre células diana/adyacentes que se encuentran en el mismo lugar mediante la simple difusion a través del liquido intersticial que las separa (cerca una de la otra);
- función Endocrina: actúa sobre células diana alejadas, siendo transportada por la circulacion sanguinea a los diversos tejidos donde actuaran;
- función Neurocrina: mediante un sistema hibrido de transmision de señales, en el cual, la señal hormonal tiene su origen en una neurona y tras el transporte axonal a la circulacion sanguineas, es llevada al una celula diana alejada (la celula secretora es una neurona).
Sinapsis quimica => señal paracrina (de neurona a neurona hasta llegar al organo diana).
Mecanismo de regulación hormonal - las hormonas sintetizadas por células de órganos diana pueden controlar por retroacción las glándulas endocrinas; el mecanismo de regulación dominante es el de la retroalimentación/ retroacción negativa; hay 3 tipos =>
- r. n. de asa larga (bucle largo de regulación por r. n.) => envía señal a larga distancia para que se deje de sintetizar hormonas estimulante;
- r. n. de asa corta (bucle corto) => e.j. la hormona de la hipófisis envia señal al hipotálamo para que no sintetice/ envié mas hormonas estimulante;
- r. n. de asa ultra corta (bucle ultra corta) => la hormona envía la señal a su propia glándula
Las condiciones fisiológicas que requieren la acción de una hormona, estimulan su liberación y los productos resultantes, suprimen su liberación; esta asociación homeostatica puede ser entre:
- una hormona y uno o mas sustratos
- una hormona y otras hormonas
- una hormona y factores químicos
También existen pautas de liberación hormonal dirigidas por => ritmos diurnos, fases del sueño, variaciones estacionales, fases del desarrollo, dolor las emociones, las lesiones, etc. a traves de complejas vías neurales;
Efecto de la unión entre hormona y receptor:
a- Cuando la unión es en la membrana plasmática de la célula, el complejo resultante actúa generando en el citoplasma moleculas de señalización como el cAMP (adenosinmonofosfato cíclico/ mensajeros moleculares) que influyen en los procesos metabólicos de la célula activando o inhibiendo enzimas pre-existentes.
b- Cuando la unión se produce en el citoplasma o en el núcleo, el complejo formado interacciona con moleculas de ADN generalmente activando un gen determinado e incrementado la síntesis de la proteína corespondiente.
Resultado => tienen que aumentar o disminuir uno o mas procesos intracelulares en la célula diana (reacciones enzimáticas, movimientos iónicos, re-ordenamientos citoesqueleticos (algo que re-establece la actividad celular).
Metodos analíticos generales para el estudio de la función endocrina:
- Medida de las concentraciones plasmáticas de las hormonas
- Cuantificación de la excreción urinaria de la hormona o sus metabolitos
- Medida de Ac circulantes que interfieren la acción hormonal o lesionan la glándula en estudio
- Determinación de la tasa de producción y secreción hormonal
- Pruebas funcionales o dinámicas, de estimulación o supresión
- Estudio de los receptores de la hormona (biopsia, cultivos celulares)
Técnicas inmunoquímicas que se utiliza con mas frecuencia en la cuantificación hormonal:
- RIA (radioinmunoanálisis) => son técnicas inmunológicas cuantitativas en las que se utilizan isotopos radiactivos como marcadores de los Ag o Ac. La radiación emitida puede ser medida con un contador (de centelleo) gamma obteniéndose la actividad radiactiva que es la velocidad de desintegración.
- EIA (enzimoinmunoanalisis) => son técnicas inmunoquimicas cuantitativas que emplea reacciones Ag-Ac, marcando uno u otro con enzimas; a la reacción inmune le sigue una reacción indicadora: se añade el sustrato de la enzima, se desarrolla la reacción enzimática y se determina la actividad de la enzima marcadora fotométricamente mediante técnicas colorimétricas habitualmente; los EIA pueden ser homogéneos y heterogéneos; se diferencian en que los ensayos homogéneos no se requiere lavado o separación física de las sustancias reaccionantes antes de medir la actividad enzimática y en los heterogéneos es necesaria la separación fisica de los reaccionantes en las fracciones libre y ligada antes de la determinación de la actividad de la enzima marcador.
***cuadro 16.6 y 16.7 pag.225
EIA heterogéneos:
- técnica competitivo => Ag Pr y Ag marcado compiten por el Ac; la actividad enzimática sera inversamente proporcional a la cantidad de Ag Pr.
- técnica sandwich => mediante procesos de lavados y incubación; la actividad enzimática es directamente proporcional a la cantidad de Ag Pr.
- técnica enzimométrico => mediante procesos de lavados y incubación; la actividad enzimática sera inversamente proporcional a la cantidad de Ag presente en la muestra problema.
- FIA (fluroinmunoanálisis) => técnica de determinación cuantitativa que emplea reacciones Ag-Ac en las que se marcan unos u otros con compuestos fluorescentes midiéndose posteriormente la fluorescencia desarrollada con aparatos llamados fluorímetros; pueden ser homogéneos o heterogéneos.
- Otras tecnicas: espectrofotométricas, cromatográficas y pruebas de inmunoaglutinación (inhibición de la hemaglutinación y aglutinación directa o indirecta de partículas de látex).
Órganos y tejidos secretores de hormonas:
1- Hipotálamo => es una parte del SNC, región del cerebro por debajo del tálamo y por encima de la hipófisis actúa en respuesta a estímulos nerviosos; ahí se encuentran células neuroendocrinas (neuronas) con capacidad de sintetizar y secretar hormonas estimulantes o inhibidoras de la hipófisis y hormonas que emigran por vía nerviosa al lóbulo posterior de la hipófisis donde se almacenan hasta su secreción, como vasopresina y oxitocina; factores liberados =>
-GHRF / somatoliberina (factor regulador de la hormona del crecimiento);
-LH-RH / gonadotropina/gonadoliberina (factor regulador de LH /lutropina/ luteinizante y FSH/ folitropina/ foliculoestimulante);
-TRH / tiroliberina (factor regulador de la tirotropina /TSH);
-CRF / corticoliberina (factor regulador de la corticotropina /adrenocorticotropa /ACTH);
- factores inhibidor => somatostatina.
2- Hipófisis => órgano glandular y nervioso, pequeño, como una aceituna situado en la base del cráneo, en una depresión osea (silla turca); consta de 2 partes anatómicas y funcional-mente diferentes (anterior/ adenohipófisis y posterior/ neurohipófisis); adenohipófisis secreta =>
ACTH / adrenocorticotropa/corticotropina => síntesis de glucocorticoides
GH / somatotropina => efectos anabólicos; crecimiento oseo y cartílago de conjunción
TSH / tirotropina => síntesis de hormonas tiroideas
FSH / folículo estimulante/folitropina => espermatogénesis, el desarrollo del folículo y síntesis de estrógenos en ovarios
LH / luteinizante/lutropina => desarrollo de las células intersticiales testiculares y síntesis de andrógenos
LTH / prolactina => producción de leche
3- Glándulas periféricas
(a) Tiroides => se localiza en la parte anterior del cuello, sobre los cartílagos de la laringe y esta constituida por 2 lóbulos unidos por un istmo; en ocasiones se puede observar un tercer lóbulo piramidal (lóbulo de Lalouette) que parte del istmo; tiene como objetivo primordial la síntesis y liberación al torrente circulatorio de las hormonas tiroideas (tiroxina/T4 y triyodotironina/T3) que se forman tras la captación del yodo y proteólisis de la tiroglobulina; la unidad funcional e histología de la tiroides es el folículo tiroideo => compuesto por una capa de células tireocitos y dentro se encuentra una sustancia peptídica yodada (tiroglobulina), que se incluye en su secuencia a T3 y T4; función =>
- influyen en el crecimiento y maduración de los tejidos
- regulan el consumo total de energía
- regulan el recambio de sustancias esenciales como vitaminas y hormonas, incluyéndose a si mismas
- ejercen acciones a nivel mitocondrial, sobre el metabolismo oxidativo y a nivel de la membrana plasmática influyendo sobre el flujo de sustratos y cationes;
El eje hipotálamo - hipófisis - tiroideas: la regulación se hace con TSH y con el contenido de tiroides; la TSH provoca estimulación tiroidea para sintetizar hormonas tiroideas; la regulación de la TSH es mediante el TRH (estimula) y hormonas tiroides (inhiben su secreción y antagonizan con el TRH);
Hipotálamo => TRH (tiroliberina) => Hipófisis => TSH (tirotropina) => Tiroides => T3 (triyodotironina) (+) T4 (tiroxina) => metabolismo basal y reacciones celulares (+) tirocalcitonina => metabolismo fosfocálcico.
Detección de los problemas tiroides:
Caso 1 - TSH aumentada y T4 disminuida => hipotiroidismo primario (problema de tiroides); al haber poco T4, la hipófisis cree que tiene que sintetizar mas TSH y estimular a la tiroides, pero la tiroides no funciona bien; si TSH alto y T4 normal => autoinmune, existe Ac anti tiroides.
Caso 2 - TSH aumentada y T4 aumentada => hipertiroidismo secundario, la disfunción puede ser de la hipófisis o del hipotálamo; habrá que determinar TRH (si TRH baja - problema de hipófisis; si TRH alta - problema de hipotálamo.
Caso 3 - TSH disminuida y T4 disminuida => hipotiroidismo secundario; la disfunción puede ser de la hipófisis o del hipotálamo; hay que determinar TRH (si TRH baja - problema de hipotálamo; s TRH alta - problema de hipófisis)
Caso 4 - TSH disminuida y T4 aumentada => hipertiroidismo primario; problema de tiroides; T4 inhibirá a la TSH, por eso esta baja, pero la tiroides seguirá produciendo T4
Hipotiroidismo; causas => falta de yodo; enfermedad genética (déficit enzimático); tratamiento del hipertiroidismo con yodo radiactivo o cirugía; tiroiditis de Hashimoto (destrucción autoinmune de la tiroides); síntomas => pulso lento, voz ronca, habla lenta, cara hinchada, caída de pelo y cejas, parpados caídos intolerancia al frió, estreñimiento, aumento de peso, cabellos escasos y secos, piel seca, síndrome del túnel carpiano, confusión, depresión, demencia; descenso del consumo calórico.
Hipertiroidismo /tirotoxicosis; causas => (1) enfermedad de Graves (autoinmune, se fabrican Ac anti receptor de la TSH en la tiroides => TSH baja; (2) nódulos toxicos (adenomas) => bocio multinodular toxico o bocio hipertrófico; (3) hipertiroidismo secundario por tumor hipofisiario que libera mucha TSH; síntomas => aumento del metabolismo general del organismo, frecuencia cardíaca, hipertensión arterial, sudor, escalofríos y temblor, nerviosismo, perdida de peso, insomnio, movimiento intestinal, diarrea, debilidad, ojos saltones y enrojecidos, sensibilidad de los ojos a la luz, mirada fija, confusión.
(b) Suprarrenal => es un organo endocrino; son 2 glándulas de pequeño tamaño situadas en los polos superiores de ambos riñones en las que se diferencian tanto anatómica como funcionalmente 2 partes:
- corteza / zona externa - secreta => hormonas corticales /esteroideas derivados del colesterol: (1) mineralcorticoides aldosterona con función => reabsorción de sodio a nivel renal (equilibrio hidrolítico) y regulación balance iónico (eliminar K+); (2) glucocorticoides cortisol con función => proteólisis, lipólisis, gluconeogénesis (causando hiperglucemia), anti-inflamatorios y inmunosupresor (3) andrógenos suprarrenales (androsterona y dehidroepiandrosterona) con función => virilización y proteogénesis;
- médula / zona interna - secreta => adrenalina (favorece la tensión arterial, taquicardia, glucemia metabolismo basal y estimula del SNC) y noradrenalina (aumenta la tensión arterial).
Síndrome Cushing => se produce por sobre exposición del organismo al cortisol/glucocorticoides (hipercorticismo) ocasionado por hiperfunción de las glándulas suprarrenales (corteza); causas => adenoma hipofisiario, corticotropina ectópica, adenoma suprarrenal, carcinoma suprarrenal; sintomas => calvicie e hirsutismo facial en mujeres; joroba de búfalo; hipertensión; adelgazamiento cutáneo hematomas con facilitad; curación defectuosa de las heridas; acne, cara de luna, mejillas pletóricas; osteoporosis; aumento de la grasa abdominal; estrías abdominales; necrosis avascular de la cabeza femoral; debilidad muscular.
El eje hipotálamo - hipófisis - suprarrenales:
Hipotálamo => CRF (corticoliberina) => Hipófisis => ACTH (adrenocorticotropa/ corticotropina) => Glándula suprarrenal => corteza (mineralcorticoides aldosterona, glucocorticoides cortisol, andrógenos /androsterona y dehidroepiandrosterona) + médula (catecolaminas /adrenalina y noradrenalina)
(c) Hormona y factores de crecimiento - la hormona de crecimiento (GH) es un polipéptido producido por el lóbulo anterior de la hipófisis; su secreción es estimulado por GHRF/ somatoliberina (factor liberador de la GH) secretado por el hipotálamo; función:
- indirecta: por medio de factores de crecimiento similares a la insulina (IGFs) que estimulan el crecimiento esquelético, la síntesis proteica y la proliferación celular; la fuente principal de estos factores es el higado;
- directa: acción antiinsulinica que provoca hiperglucemia e hiperlipemia favoreciendo la gluconeogénesis;
Pruebas diagnosticas mas utilizadas en el estudio de problema de crecimiento:
1- la valoración basal de la GH
2- los niveles séricos de los IGFs (factores de crecimiento semejantes a la insulina)
3- las pruebas de estimulación de la GH => las mas aceptadas son la prueba con GHRH y la de hipoglucemia insulínica (la hipoglucemia estimula la producción de GH)
4- las pruebas de supresión => se hacen cuando se sospecha un exceso de producción de GH (gigantismo o acromegalia)
5- las pruebas de secreción espontanea integrada => valoran la secreción de la hormona durante 24h con una determinada periodicidad o su excreción urinaria (no hay problema de secreción puntual, sino alteración en el patrón de secreción de GH).
Gigantismo => exceso de somatotropina en los niños que con lleva a un crecimiento lineal excesivamente rápido suele ser debido a un tumor hipofisiario antes de que se cierren las epífisis; otras causas: hiperplasia suprarrenal congénita, hipertiroidismo, trastornos hereditarios (sindrome de Klinefelter).
Acromegalia => es el aumento de la secreción de somatotropina en una edad posterior (al crecimiento habitual), después de la fusión de las epífisis oseas; suele ser por un adenoma hipofisiario.
(d) Gonadal (testiculo y ovario)
El eje hipotálamo - hipófisis - gónadas:
I. Hipotálamo => LH-RH (gonadoliberina) => Hipófisis => gonadotropina FSH (folículo estimulante/ folitropina) => Ovarios (estimula la maduración de ovulo y producción de estrógenos/ estradiol) o Testículos (estimula espermatogénesis)
II. Hipotálamo => LH-RH (gonadoliberina) => Hipófisis => gonadotropina LH (luteinizante /lutropina) => Ovarios (estimula ovulación y producción de progesterona/cuerpo lúteo) o Testículos (estimula producción de testosterona /andrógenos y desarrollo células intersticiales)
Ciclo menstrual => en la mujer, los niveles de gonadotropinas (FSH y LH) tienen variaciones cíclicas, cada 28 días (ciclo menstrual) aproximadamente la FSH estimula el crecimiento y maduración del óvulo (del 1er día de menstruación hasta 10-12 días) y la producción de estrógenos en el ovario; los estrógenos son hormonas feminizantes responsables de los caracteres sexuales femeninos; a lo largo del ciclo menstrual ambas hormonas (FSH y estrógenos) estimulan el desarrollo del folículo; sobre el día 10 los niveles de estrógeno que han ido aumentando estimulan el hipotálamo que determina un gran aumento en la síntesis de LH produciéndose el pico de la ovulación; esto provoca la rotura del folículo maduro y la ovulación; en la 2ª mitad del ciclo, tras la ovulación, el folículo estimulado por la LH origina el cuerpo lúteo que secreta progesterona; los altos niveles de progesterona frenan la síntesis de gonadotropina; sino hay fecundación, el cuerpo lúteo degenera y se produce la eliminación de la mucosa endometría (menstruación); descienden los niveles de estrógenos y progesterona y comienzan a aumentar los niveles de estrógenos y FSH
Fecundación => el cuerpo lúteo no degenera y sigue secretando progesterona (se ira engrosando); el ovulo fecundado se implanta en la mucosa endometría uterina, se desarrolla el embrión y la placenta que secreta estrógenos, progesterona y hormonas análogas a las hipofisiárias y sexuales como gonadotropina cariónica (hCG) y somatotropina cariónica; la hCG formada por 2 subunidades (alfa y beta) se sintetiza en los 1ºs días del embarazo con un máximo al 3er mes, luego desciende hasta 5º mes y es estable hasta el final del embarazo (el parto); en el embarazo aumentan extraordinariamente los estrógenos y la progesterona decayendo bruscamente al final; al eliminarse la placenta se secreta prolactina (LTH) hipofisiária que activa en las glándulas mamarias desarrollados por el efecto de estrógenos y progesterona => producción de leche; el amamantamiento estimula la secreción de oxitocina en la hipófisis con 2 efectos => secreción lactea y contraer la musculatura uterina para recuperar el tamaño original del útero;
Las hormonas gonadal y su secretores
Testosterona => secretada por los testículos a partir de la pubertad; función:
- función virilizante
- estimulan el desarrollo muscular y esquelético
- estimulan los caracteres sexuales masculinos: vellosidad, voz, maduración testicular, espermatogénesis
- controla la secreción de las hormonas hipotálamo-hipófisis, estimulantes del testículo (FSH y LH) retroalimentación negativa;
- responsable del crecimiento y la función de la próstata y testículos por la LH en las células intersticiales.
Oxitocina => secretada por el hipotálamo y emigra al lóbulo posterior de la hipófisis (neurohipófisis) donde se almacena hasta su secreción; función:
- favorecer la secreción láctea
- contraer la musculatura uterina para recuperar el tamaño original del útero
- estimula la contracciones en el parto
Progesterona => secretada por el cuerpo lúteo (el ovario) tras la ovulación y también secretada por la placenta (la mucosa uterina) durante el embarazo; función:
- frenar la síntesis de gonadotropinas tras la ovulación
- ayuda a la implantación del ovulo fecundado en la mucosa uterina
- ayuda al embarazo
- ayuda a desarrollar las glándulas mamarias en el embarazo
Estrógenos => secretada por el ovario durante el ciclo menstrual y también por la placenta durante el embarazo; función:
- maduración y función feminizante de órganos sexuales
- responsable de los caracteres sexuales femeninos
- estimula en el desarrollo del folículo (aumenta en 10º día del ciclo menstrual)
- estimula la ovulación
- desarrollo y mantenimiento del endometrío
- ayuda en el embarazo (placenta)
- ayuda a desarrollar la glándulas mamaria en el embarazo
Prolactina/LTH => secretada por la adenohipófisis/hipófisis anterior, gracias a la eliminación de la placenta tras el parto; función: estimula la producción de leche en las glandulas mamarias
Gonadotropina cariónica (hCG) => secretada por la placenta; esta formada por 2 subunidades (alfa y beta) se detecta en suero o orina; tiene mucha importancia en el 1er trimestre del embarazo y a lo largo de los 9 meses; es semejante a la LH y FSH y hormona sexuales; función:
- sirve para el diagnostico de embarazo normal y/o ectópico => 150-800 mUI/ml o menores;- peligro de aborto 1er trimestre(niveles persistentes bajos)
- diagnostico y tratamiento de tumores trofoblásticos (células después del cigoto)
- crecimiento y mantenimiento de la placenta
Píldora anticonceptiva - compuesto de progesterona engaña al organismo haciendo creer que hay embarazo => impide la ovulación; no deja que se desarrolla el endometrío (menos grueso); aumenta el espesor / la consistencia del flujo vaginal y así es como barrera para los espermatozoides.
Gonadotropina cariónica /hCG (secretada por la placenta) - VN en embarazo 5000-80000 mUI/ml
Variación de la secreción de hCG durante la gestación - se sintetiza en los 1ºs días del embarazo, alcanzando el máximo nivel al 3er mes de la gestación (70 días después de la ultima menstruación), luego desciende hasta el quinto mes y se mantiene estable hasta al final del embarazo.
Niveles de hCG en el embarazo ectópico - 150-800 mUI/ml o menos (niveles bajos), porque esta hormona es secretada por la placenta que se ubicara en la cavidad uterina; cuando el embrión se desarrolla ectópicamente trompas de Falopio) no va a encontrar lo necesario para sobrevivir (no endometrío, placenta sin nutrientes); el nivel de hCG aumentara al principio pero luego parara su aumento; también se pueden encontrar estos niveles de hCG en un peligro de aborto en el 1er trimestre (crecimiento embrionario normal); en caso de presencia de tumor trofoblastico, los niveles notablemente aumentados (no siempre) => altos mas de lo normal para esa época del embarazo.
Hipogonadismo primario (masculino) - producción deficiente de espermatozoides y una secreción disminuida de testosterona por causas => deficiencia testicular, hipo-función de las gónadas, agenesia testicular, agresiones testiculares, traumatismo por radiación, fármacos.
Hipogonadismo secundario - producción deficiente de espermatozoides y secrecion disminuida de testosterona por defecto en el hipotálamo o la hipófisis (ausencia de gonadotropinas)
Hipogonadismo primario (femenino) - hipo-función de los ovarios, amenorrea
Hipogonadismo secundario - secreción deficiente de estrógenos amenorrea, infertilidad, se debe a un problema con la hipófisis o el hipotálamo.
Tema 23 - Estudio de la función renal y
de los productos finales del metabolismo
Urea - es el principal compuesto de excreción del amoniaco, que se forma en el transcurso del catabolismo de los aminoácidos y las proteínas (producto final del catabolismo proteico en el higado y musculos); sintetizada en el higado a partir de los aminoácidos+bicarbonato => pasa a la sangre => eliminada por los riñones (tras la desaminación => el grupo amino => amoniaco => urea).
Valor normal en suero = 10 - 50 mg/dl
Interés clínico - el aumento de la concentración de la urea en sangre (hiperuremia) esta estrechamente relacionada con alteraciones en su eliminación por lo que es un indicador de insuficiencia renal y una gran utilidad como método sencillo de seguimiento de una insuficiencia renal ya instaurada; la urea se elimina por vía renal, siendo filtrada facilmente a nivel glomerular; una vez filtrada, se reabsorbe en un 40% a nivel de los túbulos proximales; si falla el riñon, no se filtra y se acumula en sangre; un aumento de urea en sangre, nos indicaría una causa => extrarenal (alteración hepática, hemorragia digestiva, aumento de urea por catabolismo de proteínas, aumento por exceso proteico en la dieta) o nefropática (insuficiencia renal aguda o crónica); las causas de hiperuremia:
- insuficiencia renal aguda (glomerulonefritis aguda, pielonefritis, neoplasias, cálculos renales, hemólisis)
- insuficiencia renal crónica (glomerulonefritis crónica, neoplasias, diabetes, hipertensión arterial)
Acido urico - es el producto final de la degradación de las purinas (adenina, guanina e hipoxantina) procedentes del catabolismo de los ácidos nucleicos (ADN, ARN) por la enzima xantinooxidasa; las purinas proceden de:
- exógena => el consumo de proteínas de origen animal
- endógenas => con la renovación celular; es la mas importante; al combinarse con un azucar => nucleosidos + fosfato => nucleótidos (ADN, ARN, AMP-cíclico y ATP)
Valor normal en suero = 3,4-7 mg/dl en hombres y 2,4-5,7 mg/dl en mujeres (20% menos)
Interés clínico - interviene en la renovacion celular; diariamente 60% del AU es eliminado por la orina, mediante filtrado glomerular; luego es reabsorbido en los tubulos renales 90% del total; el resto es eliminado con la bilis (vía hepatica) y los jugos pancreaticos y gastrico; los trastornos en su nivel plasmático, se manifiestan como hiper o hipo uricemia y nos pueden indicar una serie de patologías (se puede determinar en sangre y orina):
- hiperuricemia: causas metabólicas (aumento de la uricemia y uricuria) => por incremento en la síntesis de AU procedente de => la dieta rica en purinas; lisis celular (leucemias); consumo de ATP (ejercicio intenso); trastornos metabólicos hereditario (déficit enzimático); causas renales (uricuria < uricemia porque se acumula en sangre) => déficit de su secreción/ insuficiencia renal; inhibición por competitividad con ciertos metabolitos como acido láctico y cuerpos cetónicos; consecuencia de hiperuricemia => problemas a nivel articular (gota aguda/crónica y tofos => deposito de uratos), cálculos renales/ obstrucción renal de los túbulos.
- hipouricemia es causada por déficit enzimático de xantinooxidasa, hormona antidiurética /ADH y fallo en la reabsorción tubular (no hay reabsorción o la secreción es excesiva); cuando la causa de la hipouricemia es el aumento de la eliminación renal, existe riesgo de litiasis renal (uricuria > uricemia); cuando la causa es por la insuficiente síntesis de AU => ambos nivel de uricuria y uricemia son bajos;
Amoniaco - es uno de los productos finales del metabolismo de las proteínas y se forma en el intestino por acción de las bacterias sobre las proteínas y por la hidrólisis de la glutamina en el riñón; normalmente, el higado elimina la mayor parte del amoniaco en sangre que fluye por la vena porta y lo convierte en urea;
valor normal en suero = 80-100 microgramo/dl.
Interés clínico - sirve para ver la funcionalidad del higado => su metabolismo, la evolución de una hepatopatía y el grado de respuesta al tratamiento; su aumento en sangre podría afectar seriamente al equilibrio acido-base y a la función cerebral (es toxico para las neuronas); su nivel plasmático depende de la ingestión de proteínas, el ejercicio físico y algunos fármacos.
Creatina - es un compuesto nitrogenado no proteico; se sintetiza en los riñones, el intestino delgado, el páncreas y el hígado a partir de los aminoácidos metionina, arginina y glicocola; es importante para el metabolismo muscular porque constituye un importante mecanismo de almacenamiento de fosfato de alta energía (fosfocreatina); la mayor parte de creatina se encuentra a nivel muscular en forma de fosfocreatina y una pequeña parte en el plasma y en los hematíes.
Creatinina - es un producto final del metabolismo muscular; es un anhídrido de la creatina que se forma mediante una reacción espontanea e irreversible y su formación tiene una relación directa con la masa muscular; cuando este libre, no se utiliza en el metabolismo del cuerpo, y funciona únicamente como producto de excreción de la creatina; valor normal en suero = 0,5 - 1,1 mg/dl
Interés clínico - sirve como marcador precoz de la función renal, especialmente de la filtración glomerular; tras pasar por la sangre, se elimina en su mayoría via renal (filtrado glomerular) y una pequeña cantidad por las heces; su nivel plasmático es bastante constante, de manera que no se modifica ni con el ejercicio ni con las variaciones del catabolismo, por lo que cualquier incremento del nivel sérico indica problema renal, insuficiencia renal (suele ser paralelo al aumento de urea), lesión renal, prerrenal, sistémicas o vasculares del riñon u obstrucción; nunca se altera al no ser que haya alteración renal.
Aclaramiento de creatinina - se utiliza para determinar la función renal, especialmente la filtración glomerular; es la velocidad con que la creatinina es depurada de la sangre por el riñon / la velocidad con que el riñon pasa la creatinina de la sangre a la orina en un minuto; la formula:
aclaramiento de creatinina = (mg/dl creatinina - orina) x (volumen de orina /24h)(mg/dl creatinina - suero) x (60' x 24h)
Determinaciones que se realizan en suero y en orina para estudiar la función renal => urea/uremia (indicador de insuficiencia renal y su seguimiento de tratamiento) y creatinina (filtración glomerular y aclaramiento de creatinina en orina 24 h); la diferencia entre urea y creatinina como marcadores séricos de alteración renal:
1- urea => indicar insuficiencia renal rápidamente pero su aumento también depende de la ingesta proteica, catabolismo proteico endógeno, si hay hemorragias digestivas y hepatopatías (se puede ver alterada por otras causas); creatinina => aunque es mas lento que la urea, siempre indica insuficiencia renal (mas especifica), siempre que la masa muscular se mantenga constante; no se modifica ni con el ejercicio ni con variaciones del catabolismo y no depende de la dieta;
2- urea puede estar alto y la creatinina no en lesiones hepáticas (se determina GOT y GPT);
3- urea => producto de excreción de amoniaco; creatinina => producto final del metabolismo muscular;
4- urea se elimina vía renal y creatinina se elimina vía renal y heces;
Determinaciones que se deben realizar según la petición analitica:
a. Perfil hepatico => hemograma, proteinograma, factores de coagulacion, BQ (urea, amoniaco, urobilinógeno, GOT, GPT, GGT, ALP, LDH-5, BB total , LAP, 5-NT); muestra sangre total para hemograma (tubo lila), en plasma para coagulacion (tubo azul) y en suero (tubo amarillo/rojo) para el resto de las pruebas; la muestra se extrae en ayunas para hemograma; exento de hemólisis; procesamiento de inmediato, porque las enzimas pierden actividad y temperatura máxima 37º para que las enzimas no se desnaturalizan; BB protegido de la luz y refrigerado, porque es un pigmento.
b. Pre-operatorio => hemograma, pruebas de coagulacion (t.de Quick), PTT, grupo sanguíneo, BQ (glucosa, urea, creatinina, electrolitos (Na+, K+, Cl-); muestra sangre total para hemograma (tubo lila), en plasma para coagulacion (tubo azul), en suero para BQ (tubo amarillo); la muestra se extrae en ayunas o no ingerir alimento graso para no tener plasma lipémico; se rechazan el primer tubo (por la tromboplastina tisular); no tomar medicación 2 semanas antes?
c. Estudio de posible IAM o seguimiento del mismo => CK total, CK-MB, LDH-1/LDH-2, GOT, marcadores precoces (mioglobina y troponina I,T) solo se piden al principio si no se sabe cuando empezó (precoz o tardía); seguimiento => determinaciones seriadas los primeros 3 o 4 días con curva de ascenso y normalización tipicas en cada una de las enzimas y proteínas en sangre a diferentes intervalos de tiempo desde la 1a hora hasta incluso 7 días después; generalmente se realizan en suero (tubo amarillo); condiciones de urgencia => seguimiento 6, 8, 12, 24 horas - 7 días y con proteína precoces; muestra no hemolizada y procesado inmediato;
d. Perfil renal => muestra de orina en recipiente estéril: la orina 1ª hora de la mañana en ayunas para la determinación de: acetonuria, glucosuria, proteinuria, bilirrubinuria, urobilinogeno, micro albuminemia; muestra en suero (tubo amarillo) para la determinación de: urea, urato, creatinina, Na+, K+ Cl-, glucosa; el aclaramiento de creatinina no se hace de rutina; no realizar ejercicio intenso.
e. Perfil lipidico => TG /triglicéridos, colesterol, HDL, LDL; muestra en suero (tubo amarillo) en ayunas, dieta habitual 2-3 semanas antes, no realizar ejercicio físico intenso 3 horas antes, suspender medicación??? 1 mes antes y retrasar en caso de enfermedad; realizar colesterol y TG antes de 48 horas; para la lipoproteínas => solución conservante y antes de 3-4 días (muestras refrigeradas); puede salir suero hiperlipídico (diluir y repetir prueba).
Estudio del líquido seminal
El semen - es una solución compleja, compuesta básicamente por espermatozoides suspendidos en un liquido llamado plasma seminal que proporciona un medio nutritivo y volumen adecuado para llevar los espermatozoides hacia el moco cervical; es una mezcla de secreciones producidas por los testículos y las glándulas => vesículas seminales, próstata, epidídimos, conductos deferentes, glándulas bulbouretrales (Cowper) y glándulas uretrales (Littré); formación del líquido seminal => en los testículos se producen espermatozoides y hormonas sexuales masculinas => pasan al epidídimo (se maduran y se almacenan => eyaculados o reabsorbidos por el organismo); eyaculación => conducto deferente + fluidos de vesículas seminales y próstata;
- fracción pre-eyaculatoria (lubricante clara) de las glándulas uretrales y bulbouretrales- fracción previa de la próstata (ácido cítrico y fosfatasa ácida)
- fracción principal de testículo - epidídimo - deferente => espermatozoides
- fracción final de las vesículas seminales (coloide) => fructosa
Examen del liquido seminal
1. Datos del paciente => código de barras, etiqueta
2. Condiciones del examen => hora de eyaculación, hora de examen, tiempo de transporte, método de obtención abstinencia sexual, ultimo proceso febril.
3. Examen físico (macroscópico)
- Volumen normal (tras 3-5 días de continencia): 2-6 ml
- Tiempo de liquacion: debe licuarse totalmente a los 15 minutos
- Color: blanquecino
- pH: 7-8,1
- Viscosidad normal: cae gota-a gota
- Filancia: filamento menor o igual a 1cm
4. Examen microscópico
- Examen en directo - observación directa en fresco de una gota en porta => si hay o no cristales de fosfato de espermina (cristalización), leucocitos, espermatozoos, hematíes, aglutinacion, espermiofagia (fagocitados por leucocitos)
- Estudio de la motilidad - es necesario que tengan una motilidad activa para penetrar en el moco cervical y emigren hacia el ovulo; se realiza mediante la técnica de observación directa en fresco => se registra el porcentaje total de espermatozoides que presentan movilidad y inmóviles y clasificando los móviles según presenten movilidad activa (avanzan) o pasiva (se mueven pero no avanzan) o con indice de vitalidad (test de Williams Pollak) en fresco o en frotis teñido => los resultados se expresan como porcentaje de espermatozoides teñidos y se indica el indice de vitalidad que es la inversa del numero de espermatozoides teñidos (si estos son 40%, el indice de vitalidad es de 60%)
- Recuento normal 20-250 millones/ml (en cámara de Neubauer); Hiperespermia > 250 millones/ml; Oligospermia entre 1-20 millones/ml; Azoospermia => ausencia de espermatozoides maduros (presencia de células de espermiogénesis/ inmaduros); Aspermia => ausencia de espermatozoides y de células de espermiogénesis.
- Motilidad normal 60-90% movilidad (antes de 2 horas); Astenospermia => <50% de formas móviles a las 2 horas; Necrospermia => todas las formas carecen de movilidad; determinación de las categorías a,b,c,d (ha de haber un 50% entre a y b para ser fértil).
- Indice de vitalidad => estudio de necrospermia (cuantos hay de vivos y muertos); los espermatozoides vivos no se tiñen con eosina => la membrana no es permeable; valor normal => coloración con eosina <40% (vivos al 60%)
- Formula espermática => % de espermatozoides normales y anormales (anomalías de anatomía cabeza, cuello y cola); presencia de células de espermiogénesis y teratogénicas (tumoración en su maduración), de descamación y cualquier otro tipo; informe de estudio morfológico.
5. Examen Bioquímico
- Estudio próstata: Zinc => disminuido en inflamaciones (parámetro de la actividad bacteriana); Acido cítrico => transporte calcio (afecta a la motricidad de los espermatozoides); es un parámetro representativo del funcionamiento prostático; disminuido en insuficiencias prostáticas, inflamaciones y neoplasias (valores normales 250-800 mg/dl); Fosfatasa ácida => aumentada en tumores y PSA (marcador tumor) UI/ml
- Estudio vesículas seminales: Fructosa => valores normales 160-500 mg/dl; disminuida en trastornos funcionales de las vesículas seminales o déficit de testosterona.
- Estudio epididimo: Carnitina => necesaria en la adquisición de movilidad del espermatozoide; disminuida en problemas de baja motilidad.
Estudio del líquido cefalorraquídeo
El liquido cefalorraquideo (LCR) - es un liquido transparente e incoloro en el espacio subaracnoideo (entre la membrana piamadre y aracnoides de las meninges) que se forma por filtración de sangre a traves de los capilares coroideos; función =>(1) protector, amortiguador del encéfalo y médula espinal; (2) transferencia de sustancias entre la sangre y los tejidos nerviosos (el medio extra-celular de las neuronas) semipermeable; su examen sirve para =>(1) determinar infecciones, hemorragias cerebrales, aumento de la presión intra-craneal y otras afecciones del SNC; (2) diagnostico de cefaleas, entumecimiento de las extremidades y otros sintomas neurológicos;
Toma de muestras - por punción lumbar (4º espacio lumbar) se recoge 2,5-5 ml - depende de la presión repartidos en 3 tubos (bioquímica en tubo con fluoruro sódico para evitar glucólisis, citología en un tubo con heparina y microbiologia en un tubo estéril)
Examen físico - estudio de caracteres organolépticos:
- Aspecto normal: limpio, transparente y cristalino; anormal => turbio (procesos infecciosos, presencia de microorganismos, de leucocitos), empañado, opalescente o sanguinolento (extracción traumatica => tras la punción el 1er tubo sera el único sanguinolento; patología => si todos los tubos son sanguinolentos)
- Color normal: incoloro / transparente; anormal => rojizo (presencia de hematíes en hemorragia reciente, punción traumática); amarillo (xantocrómico por degradación de la hemoglobina, hemorragia antigua con bilirrubina, oxihemoglobina, ictericia, pus).
- Volumen: 90-200 ml (adultos); 10-60 ml (recién nacidos)
- Presión: 70-200 mm agua en adultos; 50-100 mm agua en niños
- Densidad: 1,005-1,008
- pH: 7,4-7,5
Examen citológico - para ver si hay infección
- Recuento celular total normal: <5 células/micro-litros (linfocitos y monocitos); >5 puede haber meningitis; patológico => pleocitosis (moderada, acentuada, extrema): patología del SNC, generalmente enfermedades inflamatorias o infecciosas.
- Recuento diferencial; técnica => concentración celular, tinción, observación microscópica (neutrófilos, linfocitos, eosinófilos, células plasmaticas con linfocitos, histiocitos malignos con linfocitos en esclerosis multiple, macrófagos en infarto craneales)
Examen químico - determinaciones de metabolitos y pH
- Proteínas normal: 0,2-0,4 g/l (importante determinación de albumina e IgG que se sintetiza en SNC para evaluar la integridad de la barrera sangre-LCR); los valores aumentados en procesos que afectan al SNC como inflamaciones, infecciones, procesos tumorales, abscesos cerebrales; es muy importante en el diagnostico de esclerosis multiple mediante electroforesis del LCR.
- Glucosa normal: 50-80 mg/dl (mitad del nivel sanguíneo); variación de la glucorraquia => disminuida en hipoglucemia y aumentada en diabetes mellitus; la determinación de glucosa es de ayuda para demostrar algún impedimiento en el transporte de glucosa desde el plasma hacia el LCR o un uso aumentado de la glucosa en SNC debido a la presencia de leucocitos o gérmenes.
- Acido láctico es aumentado en meningitis bacterianas y en hipoxia del tejido del SNC y no se modifica en las meningitis víricas.
- Lactato deshidrogenasa (LDH) se utiliza pra el diagnostico diferencial de la meningitis bacteriana y vírica.
- Creatin-kinasa (CK) aumenta en múltiples trastornos del SNC; > 4 U/L => lesión cerebral isquémica.
- Adenosindesaminasa (ADA) su aumento sirve para el diagnostico de la meningitis tuberculosa >9 U/L
- Aspartato aminotransferasa (AST/GOT) aumenta en meningitis, hemorragias y tumores.
- Cloruros se disminuye en meningitis tuberculosas y purulentas.
Examen inmunológico / serológico - detección de Ags y Acs
- Anticuerpos anti VIH
- Acs anti-microbianos (según la patología que se sospecha)
- Acs anti treponema pallidum (FTA-ABS) sífilis => afecta al SNC
Examen microbiológico - demostración del germen causal o de la etiología infecciosa
- Cultivo y antibiograma
- Tinción en porta si fuera necesario
Tipos de Meningitis => tuberculosa, bacteriana, vírica, sifilítica, micótica, parasitaria, purulenta; meningitis bacteriana => glucosa disminuida, acido láctico aumentada , LDH aumentada; meningitis tuberculosa => ADA (adenosindesaminasa) aumentada, cloruro disminuida, glucosa disminuida;
Estudio del liquido sinovial
Liquido sinovial - se encuentra en las articulaciones de las extremidades (cavidad articular); se deriva del plasma sanguíneo que se filtra a traves de los capilares sinoviales difundiendo hasta la cavidad articular, donde se añaden algunas sustancias sintetizadas en la membrana sinovial como proteínas y acido hialurónico (macromolécula compleja que le da viscosidad); función => lubricar las superficies de rozamiento; aportar nutrientes al cartílago articular; su estudio es para el diagnostico de enfermedades articulares (artritis/ inflamación de las articulaciones y artrosis/ enfermedad degenerativa articular); su análisis permite realizar un diagnostico preciso en la mayoría de las artritis infecciosas agudas y en las artropatías inducidas por cristales.
Clasificación de artritis => infecciosas, metabólicas (gota/cristales de urato; pseudogota/ condrocalcinosis/ cristales de pirofosfato de calcio), mecánicas (traumatismos, tumores), relacionadas con otras enfermedades (alergia, hemofilia), idiopáticas (reumatoide), lupus eritematoso.
Toma de muestras - mediante punción articular (artrocentesis) estando el paciente en ayunas (si se va a determinar la glucosa); se extrae 2-5 ml.
Examen físico
- Aspecto normal => amarillo pálido trasparente; anormal => lechoso (artritis, lupus eritematoso) purulento (artritis infecciosa), verdoso (artritis por haemophilus, sinovitis aguda por gota o pseudogota/ condrocalcinosis), amarillo intenso (proceso inflamatorios), rojo (artritis traumática, tumores, artropatías).
- Viscosidad y filancia: muy viscoso, pegajoso al tacto (acido hialurónico - disminuida en inflamaciones/ infecciones); se mantiene elevada en derrames traumáticos y artrosis; filamento de unos 3-6 cm.
Examen citológico
- Recuento celular total normal 10-200 células/micro-litro (leucocitos); anormal=> osteoartritis, traumatismos, gota, condrocalcinosis, artritis reumatoide, artritis infecciosa, etc.
- Recuento diferencial; técnica => frotis, tinción, estudio morfología celular (células AR, células LE, células de Reiter)
Examen de cristales - en artropatías
- Urato monosódico (gota)
- Pirofosfato cálcico (condrocalcinosis)
- Hidroxiapatita (artritis)
- Colesterol (artritis reumatoide)
Examen químico
- Proteínas normal 15-30 g/l (albumina 55-70%); aumentadas en procesos articulares en los que esta afectada la membrana sinovial (trasvasa de proteínas).
- Glucosa normal: similar a la glucemia; disminuida en procesos inflamatorios e infecciones (las bacterias la consumen); si es inferior a la mitad de la simultanea en suero, => infección bacteriana
- Lactato => indicador de inflamación (cuando es >30 mg/dl)
- Complemento => niveles reducidos con respecto a los niveles séricos simultáneos, es indicativo de artritis reumatoide y/o lupus eritematoso.
Examen microbiológico
- Sedimento
- Cultivo y antibiograma
Examen inmunológico
- Complemento
Estudio del líquido pleural, pericárdico y peritoneal
Líquido pleural, pericárdico y peritoneal - son fluidos serosos derivados del suero y secretados por las membranas con función de proteger a los órganos de la fricción; liquido pleural se encuentra entre las capas pleura visceral y pleura parietal (membranas que revisten los pulmones); liquido pericárdico se encuentra entre la capa parietal y la capa visceral que reviste el exterior de corazón liquido peritoneal se encuentra entre las capas peritoneo parietal y peritoneo visceral; efusión serosa (derrame) => se produce cuando hay un aumento anormal de la cantidad de liquido, causado por el daño en los mecanismos fisiológicos (desequilibrio) de la formación o absorción del fluido; tipos:
- Trasudados: fluidos no inflamatorios que se producen por alteración de la presión osmótica del plasma sanguíneo o la presión hidrostática capilar (no altera la membrana)
- Exudados: fluidos inflamatorios producidos como consecuencia de procesos patológicos (lesionan la membrana) con inflamación o irritación de la membrana serosa y aumento de la permeabilidad capilar.
- Derrame quiloso: fluido producido por el escape de quilo desde el conducto torácico como consecuencia de lesión u obstrucción linfática (trauma, tumor o tuberculosis)
Análisis de los derrames serosos
- Físico => observación del aspecto
- Citológico => recuento de hematíes, leucocitos y recuento diferencial
- Bioquímico => proteínas totales, ADA
- Microbiológico => cultivos
Examen químico
- Liquido pleural => determinación de proteínas para la diferenciación entre exudado y trasudado (< de 3 g/dl en trasudado; > de 3 g/dl en exudado); adenosindesaminasa (ADA) ayuda para el diagnostico de la pleuritis tuberculosa; la concentración de glucosa > a 0,5 con la sérica (< de 60 mg/dl en exudado); un nivel alto de triglicéridos indica la presencia de quilomicrones (quilotórax por traumatismo o obstrucción linfomatosa); las amilasas están aumentadas en las pancreatitis; pH < a 7,3 indican una posible evolución del derrame hacia empiema (acumulación de pus en la cavidad pleural causado por una infección en el pulmón) y si < de 6 indica rotura esofágica.
- Liquido ascítico => determinación de proteínas, glucosa, fosfatasa alcalina y amoniaco.- Liquido pericárdico => determinación de la glucosa.
Drogas de abuso
Droga - toda sustancia que introducida en un organismo vivo puede modificar una o varias de sus funciones, es susceptible de crear dependencia, y puede a la vez provocar tolerancia (incluido => nicotina, alcohol y cafeína); droga de abuso => sustancias administradas en un organismo vivo, y capaces de producir cambios en el estado de percepción, comportamiento, creando habito de consumo y presentando una sintomatología psíquica y/o de dependencia;
Analítica de dogas de abuso - el análisis inicial (screening o de presunción) y análisis de confirmación;
- La orina es muestra de elección por razones => contiene una concentración superior (solubilidad elevada) y durante mas tiempo que otras muestras; la facilidad de su obtención con procedimiento no invasivo.
- El suero o plasma y sangre total son útiles para la detección del consumo reciente, análisis toxicologia forense y analítica post-morten.
- En la analítica post-morten se emplean extractos tisulares
- En el consumo de drogas de abuso en el ultimo trimestre del embarazo, se emplea el meconio.
- La analítica de screening presentan informe cualitativo de resultados (presencia/ausencia)
(plantas de coca)
Tiempo de detección de drogas en orina- Anfetaminas: 2-4 días o superior
- Barbitúricos: 1-21 días o superior
- Benzodiazepinas: 3 días o superior
- Cannabinoides: 1-36 días o superior
- Cocaina: hasta 72 horas
- Etanol: depende del peso, la edad salud y el metabolismo individual
- Opiáceos: 2-5 días o superior
Screening /presunción - son pruebas para eliminar las muestras con resultado negativo y reducir al máximo el numero de análisis de segundo nivel (confirmación); no precisan personal especializado al ser fáciles de realizar; para ser cuantitativa, comparar con patrones de calibración; los metodos de screening son adecuados para => verificar el consumo de estupefacientes, evaluar el grado de consumo/abuso y identificar sustancias consumidas; las técnicas => se basan en la inmunoquímica (RIA/ radioinmunoensayo, EIA/ enzimoinmunoensayo, FPIA/ inmunoensayo de polarización fluorescente) y cromatografia en capa fina /TLC); test inmunológico rápido se realiza en un análisis de screening cualitativo.
(cannabis sativa)
FIA - Ac anti droga en pocillo, se introducen los Ag (muestra) y trazador (Ag comercial marcado con fluoróforos/florescencia); compiten por el Ac; si la fluorescencia es elevada habrá poca droga (el resto de fluorescencia se elimina con el lavado?); cuanto mas droga => menos fluorescencia.
EIA - Ac antidroga en pocillo, se introducen los Ag (muestra) y trazador (Ag comercial marcado con una enzima); compiten por el Ac; si hay mucha droga, quedara mucha enzima libre que reaccionara con sustrato y dara el producto coloreado (mucho color); cuanto mas droga => mas enzima => mas color.
RIA - Ac antidroga en pocillo con Ag (muestra) y trazador marcado con isotopo radioactivo; compiten por el Ac; se lava (el resto de radiactividad se elimina con el lavado); cuanto mas droga => menos radiactividad.
TLC - separación de diferentes drogas según sus características fisico - químicas; para la identificación de la droga se emplean diferentes estándares.
Metodos de confirmación - se utiliza técnica cromatografia de gases (GC), espectrometría de masas (MS) y cromatografia liquida de elevada resolución (HPLC).
(la planta opio / adormidera)
Principales drogas de abuso- Cannabinoides => cannabis sativa, THC
- Depresoras => barbitúricos, benzodiazepinas, alcohol
- Alucinógenas => fenciclidina, mescalina, LSD
- Opiáceos => heroína, codeína, dihidrocodeina, hidrocodona, hidromorfona, oxicodona, oximorfona, metadona, propofixeno, antagonistas Opiáceos
- Estimulantes => anfetaminas, cocaína
- Otras drogas => tabaco, sustancias volátiles
Marcadores tumorales (MT)
Los marcadores tumorales (MT) - macromoléculas orgánicas que se encuentran en el torrente circulatorio y/o en diversos tejidos o fluidos y cuya presencia o variación en su concentración, presenta cierta relación con la aparición y/o desarrollo de algunos tumores malignos; se encuentra en el espacio intracelular o en la superficie de las células tumorales, también pueden proceder de otras células donde ha sido inducida su producción; tipos de MT => antígenos, glucoproteínas, enzimas, hormonas, proteínas séricas, otras (zinc, cobre, etc.)
Estudio de las heces
Las heces - constituidas fundamentalmente por agua, restos alimenticios no digeridos, productos de la digestión y gran cantidad de bacterias; su análisis es útil para orientar un diagnostico;
Patologías según los hallazgos en las heces
- Detección de sangre y/o moco => patologías intestinales (colitis ulcerosa, carcinoma de colon, pólipos hemorroides)
- Detección de restos de principios inmediatos mal digeridos => patologías digestivas (síndrome de malabsorción esteatorrea, amilorrea, creatorrea)
- Detección del germen causal => infecciones intestinales (diarrea)
- Detección de huevos, quistes, parásitos => parasitosis intestinales (diarreas, anemias)
Análisis a realizar en una muestra de heces
- Examen físico-químico => caracteres organolépticos, pH, sangre
- Estudio de la digestión => examen macroscópico y microscópico (montaje húmedo directo, tinciones)
- Estudio microbiológico coprocultivo => siembras de cultivos, observación macroscópica y microscópica, tinciones, pruebas bioquímicas e inmunológicas
- Estudio parasitológico => examen macroscópico y microscópico (montaje directo, tinciones, técnicas de concentración)
Síndrome de malabsorción
- Malabsorción pancreatógena => esteatorrea (presencia anormal de grasa en las heces), creatorrea (presencia anormal de proteínas), amilorrea (presencia anormal de hidratos de carbono/almidón).
- Malabsorción hepatógena => esteatorrea- Malabsorción enterógena => en general, siendo mas importante la esteatorrea
Examen físico-químico de las heces
Caracteres organolépticos patológicos
- Moco: es patológico excepto en niños recién nacidos; masa gelatinosa formando grumos de forma irregular y consistencia viscosa; aspecto filamentoso o formando membranas; es blanquecino, mas o menos transparente; las partículas de moco de gran tamaño proceden de la porción inferior del intestino grueso; el moco finamente dividido y mezclado con las heces, procede de las porciones mas altas; indica => inflamación o irritación de la mucosa intestinal, especialmente del colon en neoplasias, colitis ulcerosa, disentería bacilar, etc.
- Pus: macroscópicamente como una masa blanquecina normalmente asociada con sangre y /o restos de mucosa; los leucocitos se observa microscópicamente en una tinción; aparecen en => colitis ulcerosa, disentería bacilar y pacientes con abscesos o fistulas anales.
- Sangre: macroscópicamente como heces rojas o melenas (heces alquitranadas) o presentarse como "sangre oculta" cuando se encuentra en menor cantidad y esta digerida; cuando es roja procede de los tramos finales del aparato digestivo; la sangre oscura esta digerida y procede de las partes altas del aparato digestivo; se encuentra en => tumores, ulceras, colitis ulcerosa, fistulas anales, hemorroides.
Determinación de pH - valor normal 6,8-7,2 (depende de la alimentación); las proteínas alcalinizan las heces (producen amonio y urea) y los hidratos de carbono las acidifican (fermentación); importante:
- reacción ácida => indica trastornos digestivos con aumento de la fermentación
- reacción alcalina => indica trastornos digestivos con aumento de la putrefacción
Investigación de sangre oculta - la técnica mas utilizada se basan en la investigación de peroxidasas como indicadores de la presencia de Hb en las heces; HEMDETECT IMMO => prueba inmunológica rapida para la detección de sangre oculta en heces; es una prueba inmunocromática especifica de detección de Hb humana.
Estudio del equilibrio hidroelectrolítico, acido básico y gaseoso del organismo humano
Equilibrio hidro-electrolítico
Neutralidad eléctrica - un estado en el cual hay una igualdad entre el total de aniones y cationes en los compartimentos liquidos corporales; los electrolitos se absorben mediante un mecanismo de:
- trasporte activo (con gasto energético);
- difusión pasiva (debido a la diferencia de gradiente electro-químico);
- difusión facilitada (acompañando al agua en su respuesta a una diferencia del gradiente osmotico/ arrastre por el solvente)
Osmolaridad - el numero de partículas de soluto, por unidad de volumen, en una disolucion expresada en miliosmoles de soluto/Litro de solucion (mOsm/L); el agua difunde en general, de una zona de menor concentración osmolar a una de mayor concentración, para igualar osmolaridades;
Mecanismos de concentración y aumento de flujo urinario - en condiciones fisiológicas de normalidad el riñon regula la concentración de solutos y mantiene la osmolaridad de los líquidos organicos dentro de los limites estrictos:
(1) Si el organismo necesita retener agua => los mecanismos de reabsorción entran en funcionamiento => aumenta la osmolaridad de la orina (mas concentrada - menos agua)
(2) Si hay un exceso de agua en el organismo => el flujo urinario aumenta => disminuye la osmolaridad (menos concentrada - mas agua)
Mecanismo de absorción y secreción de agua y electrolitos mediados por hormonas (vasopresina /ADH) y neurotransmisores:
(1) Un aumento de la osmolaridad del suero => estimula la secreción de la hormona antidiurética (ADH) que actúa sobre los túbulos renales => resorción de agua aumenta => la orina se concentra
(2) Un descenso de la osmolaridad del suero => inhibe (incluso llega a suprimir) la liberación de ADH => resorción de agua disminuye => la orina se diluye (disminuye la osmolaridad de la orina)
Evaluación del equilibrio hidro-electrolítico en el organismo (evaluar la capacidad del riñon como regulador) => determinar cualitativa y cuantitativamente los solutos presentes en la orina:
- calculando el peso especifico (densidad) de la muestra
- medir la osmolaridad urinaria (normalmente coincide con la el peso especifico)
- determinar los electrolitos presente
Con el resultado de las pruebas, también se consigue determinar:
- el estado de hidratación
- la funcionalidad de la hormona antidiurética (ADH)
- la gravedad de un estado de coma en un paciente (actividad hipotálamo/SNC)
Estudio de los electrolitos orgánicos mas importantes - el suero/plasma es el fluido biológico de elección a la hora de evaluar la composición en aniones y cationes del organismo.
Sodio (Na+) - su metabolismo tiene estrecha relación con el de agua; el desplazamiento del sodio es paralela a la del cloro; es el principal catión extracelular que rige el volumen del compartimento; Natremia normal => 135-148 milimoles/L (mEq/L); sodio en orina normal => 60-180 milimoles/L (mEq/L); su concentración es controlada por los riñones y SNC (sistema endocrino).
Hipernatremia - estado hipertónico; en suero superior a 150 mEq/L; causas => aumento del aporte, disminución de la eliminación renal, alteración endocrina, sudoración intensa, diarrea, fármacos diuréticos.
Hiponatremia - estado hipotónico; déficit del aporte, polidipsia, aumento perdidas gastrointestinales, renales, alteración endocrina, quemaduras, sudoración excesiva; clasificación de hiponatremia según la determinación volemica => isovolémicas (insuficiencia renal), hipovolémicas (vómitos o diarreas), hipervolémicas (síndrome nefrótico).
Filtración - transporte activo (consume energía)
Excreción - la mayoría por vía renal
Reabsorción - regulado por Aldosterona (umbral renal = 110-130 mEq/L)
Funciones biológicas - conserva la presión osmótica (la integridad celular), mantener el equilibrio acido-base (pH), participa en transmisión de impulsos nerviosos
Mecanismo de regulación - flujo de sangre (mas flujo => mas excreción Na+ y Cl-); anhidrasa carbónica (enzima con actividad diurética); aldosterona (actúa en reabsorción de Na+); otros esteroides/ estrógenos y progesterona (retención de agua y Na+ durante ciclo menstrual); renina (origina retención de agua y sal); ADH/ hormona antidiurética o AVP/ arginina vasopresina (regula la reabsorción/ retención de agua).
Determinación - puede realizarse en suero o en plasma; no utilizar heparina sódica como anti-coagulante; procesar las muestras antes de 3 horas (evitar el desplazamientos de ion entre el interior y el exterior); anotar fármacos que pueden aumentar/disminuir Na+ en sangre; metodos => absorción atómica/ fotometría de llama y potenciometría.
Potasio (K+) - es un catión intracelular; se transporta mediante el transporte activo (con gasto de energía celular); una ingestión diaria insuficiente puede ocasionar una grave reducción de la síntesis proteica; valores normales de Kalemia => 3,5-5 milimoles/L (mEq/L); concentración urinaria (potasuria) normal => 1,5-3,5 g/24 horas (<90mEq/dia); su nivel plasmático esta regulado por su excreción renal.
Hiperpotasemia /hiperkalemia => valores > 5,5 mEq/L; causas => aumento del aporte/ alimentos proteicos (destrucción celular, perfusión de K+); disminución de la excreción renal; acidosis metabólica (extraído de las células); valores >6,5 mEq/L puede causar problemas cardíacos incluso la muerte por paro cardíaco.
Hipopotasemia/hipokalemia => < 3,5 mEq/L; valores < 2,5 mEq/L puede causar problemas cardíacos incluso la muerte; causas => disminución del aporte, perdidas gastro-intestinales, alteraciones endocrinas, alcalosis, insulinoterapia, quemaduras graves.
Excreción - 80-90% del K+ de las células es filtrado y excretado por vía renal; no existe un umbral renal para el K+ => se sigue eliminando aunque hay carencia de K+.
Funciones biológicas - conducción nerviosa; contracción muscular; regulación de la presión osmótica; equilibrio acido-básico; regulación junto con Ca2+2 y Mg+2 del gasto cardíaco (velocidad y fuerza con que se contrae el corazón).
Determinación - útil para el diagnostico de alteraciones => del equilibrio acido-base; del equilibrio hidro-electrolítico; se utiliza una muestra de sangre venosa sin aplicar torniquete; metodos => turbidimétricos, absorción atómica, fotometría de llama.
Metabolismo fosfocálcico - se encuentra en el hueso 99% del calcio, 81% del fosfato (P) y 65% del magnesio; las cifras de fosfato siempre son evaluadas con relación a las de calcio; son cationes extracelulares que ejerce importantes funciones orgánicas => tampones acido-base, cofactores de enzimas, factores de la coagulacion, etc.
Regulación hormonal de calcio y fósforo
(1) Paratohormona/ paratiroidea (PTH) - sintetizada y secretada por las glándulas paratiroides; se regula por la concentración de Ca+2 plasmático (feedback negativo Ca+2 alta => PTH baja; nivel Ca+2 baja => PTH alta); función => mantenimiento de los niveles de calcio plasmático (reabsorción /subir el nivel de Ca+2); formación de tejido oseo nuevo.
(2) Calcitonina/ tirocalcitonina - producida el el tiroides; su secreción esta regulada por el nivel de fosfo-calcio plasmático total (hipercalcemia => su secreción alta para bajar el nivel de Ca+2; hipocalcemia => inhibe su secreción); función => es la contraria de PTH (inhibe la reabsorción de calcio y facilita el deposito de calcio nuevo (hipocalcemia); ejerce su acción a nivel oseo.
(3) Calcitriol - es la forma activa de la vitamina D3; necesita los rayos ultravioleta sobre la piel para sintetizarse; su síntesis es completada en el hígado y riñon; función => incrementa los niveles de calcio (acción paralela y sinergia con la PTH); se regula => mecanismo feedback (cuando hay hipocalcemia, hipoparatiroidismo, hipofosfatemia => la síntesis de vitamina D3 es alta).
Calcio (Ca2+) - de todo el calcio plasmático, calcio libre es la fracción ionica (fisiológicamente activa); se encuentra en el esqueleto oseo y los dientes 98%; en el plasma 2% => calcio iónico activo 46%, calcio unido a las proteínas 40% (unido a la albumina 80% y a las globulinas 20%) y formando complejos solubles de bicarbonato, citrato, fosfato y sulfato 14%; Calcemia normal => 8,5-10,5 mg/dL (2,1-2,6 milimoles/L); nivel Ca+2 esta influenciada por el pH: acidosis => favorece la disociación => aumenta Ca+2; al contrario, alcalosis => dificulta la disociación => disminuido Ca+2; calciuria normal 50-200 mg/24 horas;
Hipercalcemia - > 10,5 mg/dL (hipercalcemia grave > 13,5 mg/dL); causas => aporte elevado, tumoral, alteración del sistema endocrino, secundaria a un hiperparatiroidismo.
Hipocalcemia - causado por aporte disminuido, alteración endocrino, secundaria a hiperfosfatemia.
Aumento de Ca2+ - causado por hipoparatiroidismo primario; diuréticos tiacidicos (impide la excreción urinaria de calcio => hipercalcemia).
Disminución de Ca2+ - causado por hiperparatiroidismo primario; hormona paratiroidea ectópica (productora de tumores); ingestión excesiva de vitamina D, diversas malignidades.
Hipocalciuria - se produce en raquitismo
Hiper-calciuria - se produce en hiperparatiroidismo, hipertiroidismo,mieloma multiple.
Regulación - PTH eleva los niveles de calcio al recibir el estimulo del calcitriol; Calcitriol eleva los niveles de calcio; Calcitonina disminuye los niveles de calcio; Estrógenos aumenta los depósitos de calcio en los huesos; Andrógenos estimula la corteza suprarrenal y puede ocasionar hipocalcemia y descalcificación de los huesos.
Funciones biológicas - constituyente fundamental del esqueleto oseo; regulación hormonal (paratiroides); coagulacion sanguínea.
Metodos analiticos - utilidad: medir la actividad de la PTH; valorar la funcionalidad del metabolismo del calcio; evaluar determinadas enfermedades malignas; técnica => potenciometro.
Fósforo (P) - 85% de fósforo orgánico forma parte de la matriz osea; 15% se encuentra en el plasma => unido a proteínas (12%), como H2PO4-/fosfato diácido (10%), en forma de HPO4-2/fosfato monoácido y NaHPO4/ hidrógeno fosfato de sodio (75%); valores normales de fosfatemia en niños 4-6,5 mg/dL (2,3-3,8 mEq/L) y en adultos 3-5 mg/dL (1,78-2,9 mEq/L); las concentraciones plasmáticas de fosfato varían en función => pH; el momento de dia (ritmo circadiano noche mas bajo); aspectos fisiológicos (disminuido en el embarazo); concentración urinaria normal (fosfaturia) => 0,5-3g/24h;
Hiperfosfatemia - causas => aporte elevado (alimentos proteicos), alteración endocrina, aumento de procesos catabolismos, insuficiencia renal aguda o crónica, fármacos; nivel > 9 mg/dL => disminuye el calcio podría causar arritmias, contracciones musculares.
Hipofosfatemia - causas => alcoholismo crónico, disminución del aporte, trastornos equilibrio electrolítico (hipercalcemia), alteraciones renales (elevada perdida), alteraciones endocrinas; valores < a 1mg/dL puede causar alteraciones en la musculatura esquelética respiratoria => insuficiencia respiratoria.
Absorción - a nivel intestinal mediante un mecanismo de transporte, regulado por la vitamina D.
Excreción - vía urinaria por la acción de la PTH.
Funciones biologicas - forma parte de la matriz osea y tejido dentario, tejido nervioso, proteínas celulares, membrana celular; equilibrio acido-base (el sistema HPO4-2 / H2PO4- en el plasma actúa como tampón interviene en la contracción muscular; participa en los mecanismos de absorción y metabolismo de los principios inmediatos.
Magnesio (Mg2+) - se encuentra en el hueso 65-70%; su estudio tiene escaso valor clínico; valores normales de magnesemia => 1,8-2,9 mg/dl (1,5-2,5 mEq/Litro); todos los alimentos naturales (leche y legumbres) son ricos en Mg; es difícil tener un déficit en la dieta; una dieta pobre en potasio o calcio, dificulta el proceso de absorción del Mg.
Función biológicas => muy relacionadas con las funciones de calcio en el organismo (mantener el nivel calcio intracelular; equilibrio neuromuscular); participa en procesos de transferencia energética (cofactor en sistemas enzimáticos ATP-asa); es indispensable para metabolismo de carbohidratos, síntesis de proteínas, síntesis de ácidos nucleicos.
Hipermagnesemia => valores > 3,5 mEq/L
Estudio del equilibrio ácido-básico
Ácido - sustancia que pueda dar un protón a otra (dador de protones) y aceptor de un par electrónico
Base - sustancia que pueda aceptar protones de otra (aceptor de protones) y dador de un par electrónico;
PH sanguineo normal (7,35-7,45) se encuentra en el lado alcalino de neutralidad;
Tampón (amortiguador) - una mezcla de un ácido y su base conjugado con función fundamental => la de resistir los cambios de pH;
Equilibrio acido-basico - aquella situación de equilibrio, establecido en el balance entre sustancias de carácter acido y de carácter básico de la sangre, como consecuencia de la interrelación entre los sistemas respiratorio y metabólico; alteración respiratoria => la concentración de CO2 o ácido carbónico constituye el cambio primario; alteración metabolica => la alteración de la concentración de bicarbonato (HCO3-).
Regulación del equilibrio acido-basico - evitar las variaciones en el pH es la tarea de los tampones (sistemas amortiguadores) presentes en el organismo, capaces de captar o liberar protones (H+) como respuesta a os cambios de acidez de los distintos líquidos orgánicos con la ayuda de los pulmones y los riñones.
La acidosis - exceso de H+ en la sangre (acidemia); pH < 7,35La alcalosis - déficit de H+ en la sangre; pH > 7,45
Tampones mas importantes del organismo - en el plasma => tampón bicarbonato/ acido carbónico (H2Co3 / HCO3-); tampón fosfato (H2PO4-); proteínas plasmáticas; en los hematíes => tampón Hb y bicarbonato/ acido carbónico.
Determinar la alteración del equilibrio acido-base - la concentración H+, HCO3-, Pco2;- determinar la presión parcial de CO2 (en caso de trastornos respiratorios)
- determinar la concentración de bicarbonato (en caso de trastornos metabólicos)
Clasificación de las alteraciones del equilibrio ácido básico:
- Metabólica: déficit primario de HCO3- => acidosis; aumento primario de HCO3- => alcalosis
- Respiratoria: aumento primario de CO2 => acidosis; déficit primario de CO2 => alcalosis
Equilibrio gaseoso
Ventilación - intercambio de aire, entre la atmósfera y los alvéolos
Difusión - intercambio de gases a traves de la membrana de los alvéolos pulmonares
Perfusión - paso de la sangre a traves de los vasos sanguíneos pulmonares
Oxigeno => disuelto en plasma (presión parcial de oxigeno /Po2) y unido a la Hb; valor normal Po2 en sangre => 97 mmHg o entre 80-100 mmHg (varia con la edad); < de 80 mmHg => hipoxemia; excepciones neonatos entre 40-70 mmHg.
Dióxido de carbono /anhídrido carbónico =>disuelto en plasma (como CO2 y como bicarbonato o acido carbónico) y unido a la Hb; valores normales en la sangre Pco2 => 35-45 mmHg (no varia con la edad)
Insuficiencia respiratoria:- alteraciones en la perfusión (a nivel de la circulación pulmonar)
- alteraciones en la difusión (a nivel de la membrana alveolo-capilar)
- alteraciones en la ventilación => obstructiva, restrictiva, mixta
Pruebas funcionales respiratorias - espirografía simple y gasometría arterial
Monitorización de fármacos (MF)
Se recomienda la monitorización de un fármaco cuando:
- Su ventana terapéutica es reducida y bien definida
- Se sospecha incumplimiento del tratamiento
- Se sospechan interacciones con otros medicamentos
- Se observan posibles sintomas de toxicidad
- Se sospecha inefectividad (no se observa la respuesta terapéutica esperada)
- Se observa gran variabilidad individual en la farmacocinética
- Existen otras patologías que pueden modificar la respuesta
- Existe un estado fisiológico que puede modificar la respuesta
- Se exige una revisión o seguimiento clínico-legal del tratamiento
Farmacocinética => absorción - distribución - eliminación (metabolismo - excreción)
Programa de monitorización de fármacos - se basa en la relación individual existente entre la concentración sérica del fármaco y su respuesta clínica , estableciendo los indicadores de respuesta adecuados para cada fármaco => se encarga la unidad de farmacocinética clinica en el hospital
Indicaciones para la monitorización de fármacos- es aconsejable realizar la monitorización de fármacos cuando:
- Se sospechan interacciones medicamentosas
- Se sospecha una mala aplicación del tratamiento (no respetar las dosis, no terminar)
- Se conoce la dificultad de aplicación del tratamiento, p.ej. en la población anciana
- El fármaco tiene un margen o ventana terapéutica estrecho
- No se alcanza el efecto terapéutico deseado con la dosis indicada
- Se observan sintomas y/o signos de toxicidad
- Se observa variabilidad inter-individual con respecto al metabolismo
- El metabolismo esta alterado debido a otra patología subyacente
- El metabolismo esta alterado como consecuencia del estado psico-físico del paciente
- Se cuestiona la bio-disponibilidad de la formulación administrada
- Se requiere un seguimiento o comprobacion medico-legal del tratamiento
Técnicas electroquímicas
La química electro-analítica - un grupo de metodos analíticos cuantitativos basados en las propiedades eléctricas de la disolucion de un analito cuando forma parte de una célula eléctrica.
La célula electro-química - 2 conductores (electrodos), cada uno sumergido en una solución adecuada de electrolito, un puente salino inerte entre ambos para que circule la corriente eléctrica y un potenciometro para medir la diferencia de potencial generada.
Fundamento
- Reacción de oxidación: átomo metálico neutro => ion positivo + electrón (soltado); Mº => M+ + e-
- Reacción de reducción: ion positivo + electrón => átomo metálico neutro; M+ + e- => Mº
Las técnicas electroquímicas mas utilizadas en el laboratorio clínico son las amperométricas y las potenciométricas; los metodos amperométricos se basan en la medida de la cantidad de corriente que fluye cuando se aplica un voltaje constante al electrodo de medida (dinámicos); los metodos potenciométricos se basan en la medida del potencial de las células electroquímicas en ausencia de corriente (estáticos);
Su utilidad en el laboratorio:
- Medida del pH
- Determinación de concentración de iones
- Medida de la presión parcial de gases (CO2 y O2) => PO2 y PCo2
- Medidas del punto final de metodos volumétricos
- Medida del poder de oxidación o reduccion de una solucion
El equipo requerido para estos metodos es simple, consta de => electrodo de referencia, electrodo indicador,dispositivo para medir el potencial.
Estudio de la orina
Función del riñón:
- La eliminación de nuestro organismo de una importante cantidad de residuos metabólicos, muchos de ellos inútiles, y de otros que incluso pueden comportarse como tóxicos.
- La regulación de la composición de los fluidos de nuestro organismo facilitando así, tanto la supervivencia de las células como el optimo desarrollo de todos los procesos metabólicos.
- El control hormonal de la presión arterial (adrenalina, noradrenalina)
- El control de los niveles orgánicos del calcio (mineral corticoides aldosterona, 1,25 dihidroxicolecalciferol)
- El control de la eritropoyesis (eritropoyetina)
Nefronas - son unidades funcionales básicas consiste de 2 partes => el glomerulo (dentro de la cavidad "capsula de Bowman") y la red tubular.
El glomerulo - filtrar/ depurar el plasma 25 ml de sangre por minuto (150 litros de plasma/ dia); se filtra agua, urea, creatinina, aminoácidos, ácido úrico, glucosa, proteínas de bajo pm.
La red tubular - el filtrado por el glomerulo es recogido en la capsula de Bowman y se dirige hacia la red tubular donde se lleva a cabo un proceso de reabsorcion selectiva => reabsorber agua, ciertos elementos útiles par el organismo y que deben ser recuperadas (glucosa, agua, sodio, cloruro, potasio, bicarbonato, urea, aminoácidos, proteina) y permite la secreción de otras que, po su toxicidad, deben ser posteriormente eliminadas mediante la micción (amonio, urea, hidrogeniones); se elimina 1 ml de orina por minuto (1500 ml diarios)
Características fundamentales en recogida de muestras de orina
- Micción espontanea => análisis fisico-químico, estudio del sedimento, concentración de creatina.
- Cateterismo vesical (sondaje) => pacientes que presentan dificultades de la micción, mujeres para evitar la contaminación vaginal.
- Puncion suprapubica => diagnostico de infección por microorganismos extraños en niños.
Tipos de muestras para un análisis de orina (sin supervision):
- Primera orina de la mañana => se recomienda porque la concentración de solutos es variable a lo largo del día y esta en relación con la ingesta de liquidos.
- Orina tomada al azar => muestra valida para cultivos microbiologicos
- Orina minutada (fraccionada, de 2 horas, de 24 horas) => gran utilidad para el paciente diabeticos
Análisis de orina - objetivos:
- obtener información del estado general del riñon y las lesiones que pudieran afectarlo
- detectar la existencia de una alteración a nivel de las vías urinarias
- teniendo en cuenta aquellos productos que se eliminan vía urinaria, detectar alteraciones funcionales de otros órganos
- detectar las alteraciones metabólicas de diversa etiologia
- se intenta encontrar sustancias o componentes que normalmente no se encuentran en la orina
- detectar alguna alteración en la concentración (por defecto o por exceso) de componentes que habitualmente se encuentran en la orina
Tipos de análisis de orina => análisis elemental, completo, rutinario, anormales y sedimento.
Parámetro bioquímico => Densidad - Bilirrubina - Cuerpos cetónicos - Proteínas - Urobilinogeno - Glucosa - Hemoglobina - Nitritos.
Examen físico - macroscopico
1)- Cantidad / diuresis normal 800-200 ml; alteración => oliguria, poliuria, anuria
2)- Aspecto / turbidez clara y transparente; alteración => gelatinoso, opalescente, turbidez con sedimento rojo, espuma persistente de agitar (albumina)
3)- Color amarillo / ámbar (en función de la concentración)
4)- Olor aromático, ligeramente amoniacal
5)- Densidad 1.010-1.030 (se determina mediante urodensimetro, tiras reactivas o refractrometria); alteración => insuficiencia renal, diabetes, trastornos nerviosos, procesos febriles
6)- pH 4,5-8,2 (normal pH 6)
Importancia clínica del estudio de "anormales" en orina
Proteínas - en condiciones normales las proteínas se encuentran 130-150 mg/día en función del volumen de orina eliminado; en recién nacidos 2-8 mg/100 ml; cantidad de proteina => albumina 1/3 del total (fisiológica), globulinas, proteina de Tamm-Horsfall (T-H) no se encuentra en el plasma - se forma en el tubulo contorneado distal, transferrina, IgA; proteinuria => eliminación de proteina en orina superando los VN (intensa >4 g/dia: leve <0,5 g/dia)
Glucosa - la orina normal carece casi por completo de glucosa; normoglucemia => 6-120 mg/dl; umbral renal 160 mg/dl; glucosuria => aumento de la concentración de glucosa en orina por encima de los VN, causada por (1) aumento de la glucemia por encima de umbral renal (2) alteración renal (tubulopatia)
Cuerpos cetónicos - en personas sanas, los CC se sintetizan en el hígado y se metabolizan por completo, de forma que en la orina aparecen en concentraciones mínimas (indetectables); cetonuria => aparición de cueros cetónicos detectable sen orina; la presencia de cetonuria y el aumento de cetonemia implica que no se realiza correctamente el catabolismo oxidativo de los ácidos grasos; las causas de cetonuria:
- sobrecarga de lipidos en la dieta
- diabetes mellitus (coma diabetico)
- vómitos (niños embarazadas)
- bajo consumo de hidratos de carbono o alteración en su metabolismo
- ayuno prolongado
Hemoglobina - no aparece en orinas normales; hemoglobinuria => presencia de Hb en orina (si la cantidad en alta, se puede ver a simple vista); causas => enfermedad renal de vías altas, anemias hemolíticas reacciones transfusionales, infecciones (malaria, paludismo)
Pigmentos biliares (bilirrubina y biliverdina) - aparece BB en orina, siempre que aumente la BB directa en sangre por causas => enfermedad obstructiva, lesiones hepáticas.
Uribilinogeno - BB directa con la bilis, pasa al intestino delgado donde por acción de la flora bacteriana se transforma en urobilinogeno o estercobilinogeno (se elimina en mayoría con las heces y la orina en menor concentración); la cantidad de urobilinogeno aumenta en la orina en las hepatitis y las anemias hemolíticas; la determinación de urobilinogeno debe realizarse rápidamente en orina, ya que se transforma en urobilina + O2 (falso negativo).
Nitritos - su aparición en la orina indica crecimiento bacteriano (bacteriuria), de germenes capaces de reducir los nitratos ingeridos con la dieta, hasta nitritos (entero-bacterias); un resultado negativo de la prueba de los nitritos, no indica ausencia de microorganismos, ya que puede haber bacterias que no son productores de nitritos o ausencia de nitratos ingeridos en la dieta.